2,3,5-Trimethylphenol
2,3,5-Trimethylphenol ist eine chemische Verbindung aus der Gruppe der Alkylphenole. Es ist eines von sechs möglichen Trimethylphenolen und leitet sich vom Pseudocumol ab. Der Trivialname Pseudocumenol ergibt sich aus der Bezeichnung Cumenol für die strukturisomeren Isopropylphenole.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
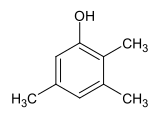
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,3,5-Trimethylphenol | ||||||||||||||||||
| Andere Namen |
Pseudocumenol | ||||||||||||||||||
| Summenformel | C9H12O | ||||||||||||||||||
| Kurzbeschreibung |
beiges Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 136,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig in heißem Wasser löslich[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen
Bearbeiten2,3,5-Trimethylphenol kommt natürlich in Arabica-Kaffeebohnen vor.[3]
Gewinnung und Darstellung
BearbeitenNach Edler 1885
Bearbeiten2,3,5-Trimethylanilin[4] wird einer Phenolverkochung unterzogen.[5]
Nach Jacobsen und Schnapauff 1885
Bearbeiten2-Hydroxy-3,4,6-trimethylbenzoesäure (Oxydurolsäure) reagiert bei 200 °C mit Salzsäure. Dabei findet eine Decarboxylierung zum Produkt statt.[6]
Nach Jacobsen 1886
Bearbeiten2,3,5-Trimethylbenzolsulfonsäure[7] wird mittels Natronlauge in ihr Natriumsalz überführt und dieses dann mit Kaliumhydroxid verschmolzen. Durch saure Hydrolyse der Schmelze entsteht das Produkt.[8][2]
Eigenschaften
BearbeitenChemische Eigenschaften
BearbeitenDie beiden verbleibenden Aryl-Positionen lassen sich durch einen Überschuss an elementarem Brom bromieren. Es entsteht das 2,4-Dibrom-3,5,6-trimethylphenol (wobei die Lokanten sich nur aufgrund der Nomenklatur ändern).[2]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Datenblatt 2,3,5-Trimethylphenol bei Sigma-Aldrich, abgerufen am 23. Juli 2024 (PDF).
- ↑ a b c d e O. Jacobsen: Ueber Pseudocumolsulfonsäuren und Brompseudocumolsulfonsäuren. In: Berichte der deutschen chemischen Gesellschaft. Band 19, Nr. 1, 1886, S. 1218–1223, doi:10.1002/cber.188601901275.
- ↑ 2,3,5-TRIMETHYLPHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 9. Juli 2024.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,3,5-Trimethylanilin: CAS-Nr.: 767-77-1, PubChem: 12782408, ChemSpider: 10676757, Wikidata: Q82367579.
- ↑ E. Edler: Ueber das Nitropseudocumol, Pseudocumidin und Pseudocumenol von der Stellung 1, 3, 4, 5. In: Berichte der deutschen chemischen Gesellschaft. Band 18, Nr. 1, 1885, S. 629–630, doi:10.1002/cber.188501801137.
- ↑ O. Jacobsen, E. Schnapauff: Ueber einige Derivate des Durols. In: Berichte der deutschen chemischen Gesellschaft. Band 18, Nr. 2, 1885, S. 2841–2844, doi:10.1002/cber.188501802193.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,3,5-Trimethylbenzolsulfonsäure: CAS-Nr.: 111513-16-7, PubChem: 18716016, Wikidata: Q82490898.
- ↑ O. Jacobsen: Ueber die Einwirkung von Schwefelsäure auf Durol und über das dritte Tetramethylbenzol. In: Berichte der deutschen chemischen Gesellschaft. Band 19, Nr. 1, 1886, S. 1209–1217, doi:10.1002/cber.188601901274.
