2,6-Lutidin
Das 2,6-Lutidin (2,6-Dimethylpyridin) ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Es besteht aus einem Pyridinring, der mit zwei Methylgruppen substituiert ist. Es gehört zur Stoffgruppe der Lutidine, einer Gruppe von sechs Konstitutionsisomeren mit der Summenformel C7H9N. Es besitzt einen charakteristischen nussartigen Geruch.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
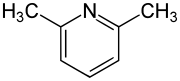
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,6-Lutidin | |||||||||||||||
| Andere Namen |
2,6-Dimethylpyridin (IUPAC) | |||||||||||||||
| Summenformel | C7H9N | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 107,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,923 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
144 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert |
6,60 (25 °C)[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4953 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
Bearbeiten2,6-Dimethylpyridin kommt natürlich in Teeblättern und den Blättern der Pfefferminze vor.[4] Es wurde aus Steinkohlenteer[5] und Knochenöl isoliert.[6]
Darstellung
BearbeitenDie Darstellung erfolgt analog der Hantzschschen Dihydropyridinsynthese aus Acetessigsäureethylester (als β-Ketocarbonylverbindung), Formaldehyd und Ammoniak im Verhältnis 2:1:1 in Gegenwart von etwas Diethylamin.[7] Durch Oxidation der Methylgruppen entsteht die Dipicolinsäure.
In der organischen Synthese dient das 2,6-Lutidin als sterisch gehinderte Base, beispielsweise bei der Schützung von Alkoholen als Silylether.[8]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i Eintrag zu 2,6-Lutidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juli 2017. (JavaScript erforderlich)
- ↑ Zvi Rappoport: CRC Handbook of Tables for Organic Compound Identification, Third Edition, CRC Press, Boca Raton, Florida, 1984, ISBN 0-8493-0303-6, S. 438.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-210.
- ↑ 2,6-DIMETHYL-PYRIDINE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 10. Juli 2024.
- ↑ G. Lunge, J. Rosenberg: Ueber die Lutidine des Steinkohlentheers, in: Berichte der deutschen chemischen Gesellschaft, 1887, 20, S. 127–137 (doi:10.1002/cber.18870200132).
- ↑ A. Ladenburg, C. F. Roth: Studien über das käufliche Picolin, in: Berichte der deutschen chemischen Gesellschaft, 1885, 18, S. 47–54, hier S. 51 (doi:10.1002/cber.18850180110).
- ↑ Alvin Singer, S. M. McElvain: 2,6-Dimethylpyridine In: Organic Syntheses. 14, 1934, S. 30, doi:10.15227/orgsyn.014.0030; Coll. Vol. 2, 1943, S. 214 (PDF).
- ↑ Eintrag zu Lutidine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juli 2017.
Weblinks
Bearbeiten- Eintrag zu 2,6-Lutidin. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD

