Endokrine Orbitopathie
Die endokrine Orbitopathie (von lateinisch orbis ‚Kreis‘ und altgriechisch πάθος páthos, deutsch ‚Leidenschaft, Sucht‘; endokrin ‚nach innen abgebend‘; Synonyme endokrine Ophthalmopathie, EO) ist eine Erkrankung der Augenhöhle (Orbita). Sie zählt zu den organspezifischen Autoimmunerkrankungen und tritt meist gemeinsam mit einer Schilddrüsenfehlfunktion auf (endokrin), wobei Frauen erheblich häufiger betroffen sind als Männer.
| Klassifikation nach ICD-10 | |
|---|---|
| H06.2* | Exophthalmus bei Funktionsstörung der Schilddrüse |
| ICD-10 online (WHO-Version 2019) | |
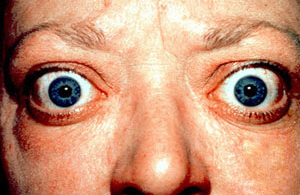
Klinisch äußert sie sich mit einem deutlichen Hervortreten der Augen (Exophthalmus), hochgezogenen Oberlidern (Lidretraktion) und einer damit verbundenen Erweiterung der Lidspalten. Auslöser für dieses auffällige Krankheitszeichen sind strukturelle und größenmäßige Veränderungen des hinter dem Augapfel (retrobulbär) gelegenen Muskel-, Fett- und Bindegewebes.
Zusammen mit Herzrasen (Tachykardie) und einer Vergrößerung der Schilddrüse (Struma) bildet der Exophthalmus die sogenannte Merseburger Trias, einen dreiteiligen (Trias) Symptomkomplex. Dieser gehört zu den klassischen, aber nicht zwingenden klinischen Zeichen des Morbus Basedow und wurde bereits 1840 von Carl Adolph von Basedow, der seinerzeit in Merseburg tätig war, beschrieben.
Der Krankheitsverlauf weist unterschiedliche Schwere- und Aktivitätsgrade auf. Wegen des auffälligen kosmetischen Erscheinungsbildes können sich zu den organischen und funktionellen Problemen auch starke psychosoziale Belastungen gesellen, unter denen Betroffene zu leiden haben. Zwar existieren eine ganze Reihe von symptomatischen Behandlungsmaßnahmen, eine die Ursachen behebende (kausale) Therapie ist bislang jedoch nicht bekannt.
Ursache und Häufigkeit
BearbeitenDie Ursache der endokrinen Orbitopathie ist bis heute unbekannt. Als wahrscheinlich gilt eine erblich bedingte Autoimmunerkrankung, die für die Bildung von Autoantikörpern gegen Thyreotropin-Rezeptoren verantwortlich ist (das Hormon Thyreotropin, kurz TSH, beeinflusst maßgeblich das Schilddrüsenwachstum). Diese Rezeptoren finden sich auch im Gewebe der Augenhöhle.[1]
Die endokrine Orbitopathie kommt bei 10 % aller Schilddrüsenerkrankten vor und tritt in bis zu über 90 % der Fälle gleichzeitig im Rahmen eines Morbus Basedow,[1][2] dabei zu 60 % in Verbindung mit einer Schilddrüsenüberfunktion (Hyperthyreose) auf.[3][4] Für die Häufigkeit (Prävalenz) des Morbus Basedow in Deutschland gibt es allerdings keine genauen Angaben. In Gebieten mit ausreichender Jodversorgung wird diese bei Frauen mit 2 bis 3 %[5] und bei Männern mit ungefähr einem Zehntel davon angegeben. Die jährliche Neuerkrankungsrate des Morbus Basedow liegt bei 1 pro 1.000 Einwohner.[6] Die endokrine Orbitopathie kann sich jedoch auch zeitlich vor oder erst Jahre nach der Entstehung von Schilddrüsenstörungen entwickeln.[7] Die endokrine Orbitopathie wird daher als außerhalb der Schilddrüse (extrathyreoidal) gelegene Manifestation der dem Morbus Basedow zugrundeliegenden Autoimmunprozesse interpretiert. Somit werden die gleichen Ursachen angenommen. Dabei spielen genetische Veranlagung, Umwelteinflüsse, deren Bedeutungen noch nicht eindeutig geklärt sind, und ein komplexer immunologischer Prozess eine Rolle.[8] Auch unter Radiojodtherapie kann sich eine bis dato leichte, oder klinisch inapparente (unauffällige) endokrine Orbitopathie ausbilden oder deutlich verschlechtern.[9]
Nur selten findet sie sich jedoch auch bei einem Morbus Hashimoto oder gänzlich ohne Nachweis einer Schilddrüsenbeteiligung.[10] Übermäßiger Nikotingenuss (Nikotinabusus) kann den Verlauf und Schweregrad der Krankheit negativ beeinflussen.[11] Die endokrine Orbitopathie tritt bei Frauen sechsmal häufiger als bei Männern auf, wobei die schweren Fälle bei Männern deutlich überwiegen. Thyreotropin-Rezeptor-Autoantikörper (TSH-Rezeptor-Antikörper) korrelieren mit der Aktivität der Erkrankung und helfen, die Prognose einer endokrinen Orbitopathie einzuschätzen.[12]
Obgleich die endokrine Orbitopathie in den allermeisten Fällen mit Schilddrüsenerkrankungen einhergeht, ist ein ursächlicher Zusammenhang bisher nicht bewiesen, weshalb sie auch als eigenständige Autoimmunerkrankung betrachtet wird.[3]
Der im angloamerikanischen Sprachraum geläufige und synonym verwendete Begriff Graves ophthalmopathy stellt bereits einen direkten Zusammenhang zwischen dem gehäuften Auftreten dieser Augenerkrankung und einem Morbus Basedow (engl.: Graves’ disease) her.[13] Der irische Arzt Robert James Graves beschrieb bereits 1835 einen Fall von krankhafter Schilddrüsenvergrößerung (Struma) in Kombination mit einem Exophthalmus.[14]
Krankheitsentstehung
BearbeitenDas Auftreten einer endokrinen Orbitopathie ist die Folge von komplexen Abwehrmechanismen des Körpers gegen eigenes Gewebe (Autoimmunprozesse),[8] die durch bestimmte Blutzellen, sogenannte B- und autoreaktive T-Lymphozyten, ausgelöst werden und mit einer vermehrten Bildung von Antikörpern (Thyreotropin-Rezeptor-Autoantikörpern, TRAK) einhergehen. Es gibt Hinweise darauf, dass TRAK mit stimulierenden Eigenschaften (thyroid stimulating antibodies, TSAb) die Ausbildung einer endokrinen Orbitopathie besonders begünstigen,[15] der genaue Mechanismus ist jedoch bislang nicht bekannt. Auch andere Rezeptor-Antikörper (z. B. die insulinähnlichen Wachstumsfaktoren) könnten eine Rolle spielen.[16]
Im Vergleich zu anderen Bereichen des Körpers reagieren bestimmte Bindegewebszellen, sogenannte Fibroblasten, im retrobulbären Gewebe besonders stark auf entzündungsartige Reize, insbesondere auf eine Stimulation spezieller Antigene, sogenannter CD40-Proteine, was zur Bildung neuer Fettzellen führt. Ebenfalls begünstigend wirken eine genetische Vorbelastung sowie Tabakkonsum.[16]
Die so ausgelöste immunologische Entzündung führt in der Augenhöhle zum Anschwellen des Muskel-, Fett- und Bindegewebes, verbreitert den Abstand zwischen Orbitawand und Augapfel und führt dadurch sowohl zu einem Hervortreten des Auges (Exophthalmus), als auch zu einem Elastizitätsverlust der Augenmuskeln mit Bewegungseinschränkungen und Doppelbildern. Maßgebliche Ursache für diesen Prozess sind Durchdringungen des Gewebes mit Lymphozyten (lymphozytäre Infiltrationen) sowie eine Zunahme der Fibroblasten. Darüber hinaus kommt es zur Vermehrung eines Bindegewebsbaustoffes, dem Kollagen, bei gleichzeitiger Zunahme weiterer eingelagerter Glykosaminoglykane und einer übermäßigen Ansammlung von Wasser im Gewebe. Eine typische Erscheinung der Augenmuskeln und seltener auch des Sehnerven ist zudem ein diffuses Fettgewebswachstum, eine sogenannte Lipomatose.[1][8][17][18][19]
Klinische Erscheinungen
BearbeitenDie endokrine Orbitopathie tritt ein- oder beidseitig auf, dann jedoch oft unterschiedlich stark ausgeprägt.[2] Andere Quellen verweisen auf ein eher bilateral symmetrisches Krankheitsbild.[20] Sie besitzt eine Reihe von sich dynamisch verändernden klinischen Merkmalen, die in aller Regel durch Entzündungen, strukturelle Wandlung und einer Volumenzunahme von hinter dem Auge gelegenem, orbitalem Fett-, Binde- und Muskelgewebe verursacht werden (siehe auch: Periorbita). Ist die endokrine Orbitopathie so stark ausgeprägt, dass ein vollständiger Lidschluss nicht mehr möglich ist (Lagophthalmus) und daher Hornhautgeschwüre auftreten, so spricht man von einem malignen Exophthalmus.[19][21]
Wie auch andere Erkrankungen kann die endokrine Orbitopathie die Betroffenen psychisch stark belasten.[22] Neben den allgemeinen Beschwerden, den funktionellen Einschränkungen durch Doppelbilder und Kopfzwangshaltungen, die in der Regel deutliche Hindernisse in vielen Lebensbereichen darstellen können, kann der kosmetisch-ästhetische Aspekt zu einem sozialen Rückzug führen.[23]
Augenhöhle (Orbita)
BearbeitenDer Exophthalmus, das Hervortreten eines oder beider Augen aus der Augenhöhle, ist das klassische Leitsymptom der endokrinen Orbitopathie und Resultat einer schmerzhaften Ausbreitung von retrobulbärem Gewebe, das sich bis in die Augenlider vorwölben kann.[17] In 3 % der Fälle kommt es darüber hinaus zu Weichteilschwellungen in der Orbitaspitze (z. B. Ödeme) und in Folge zu einer Kompression und somit Schädigung des Sehnerven mit Verschlechterung der Sehschärfe und entsprechenden Gesichtsfeldausfällen.[17]
Das Ausmaß des Exophthalmus lässt sich mit einem augenheilkundlichen Untersuchungsgerät, dem sogenannten Exophthalmometer, quantifizieren und erlaubt somit auch die Dokumentation von Verlauf und Status. Raumfordernde Prozesse und Platzverhältnisse in der Orbita können mit bildgebenden Verfahren (Ultraschall, CT, NMR) dargestellt werden. Eine Untersuchung von Gesichtsfeld und Sehschärfe erfolgt mittels Perimetrie und Sehtests.
Augenmuskeln
BearbeitenBewegungsstörungen entstehen durch Schwellung, Infiltration oder krankhafte Gewebevermehrung (Fibrosierung) der Augenmuskeln, wobei eine Vergrößerung bis auf das Zehnfache ihres üblichen Volumens möglich ist.[20] Als Folge kommt es zu einem Elastizitätsverlust mit teils deutlich eingeschränkter Dehnbarkeit, häufig einhergehend mit Schmerzen bei Blickwendungen. Die Bewegungseinschränkungen treten nicht in Muskelzugrichtung als ein Ausdruck verminderter Muskelkraft auf, sondern in die entgegengesetzte Richtung, was sich quasi als scheinbare Lähmung (Pseudoparese) des gleichseitigen muskulären Gegenspielers (Antagonist) darstellt. Klinische Zeichen zum Beispiel sind die Einschränkung der monokularen Blickfelder, Schielen und Doppelbilder mit kompensatorischen Kopfzwangshaltungen.[17][24][25] Ein weiteres, typisches Symptom ist das sogenannte Möbius-Zeichen, eine teils ausgeprägte Unfähigkeit, beide Augen gleichzeitig zur Nase hin zu bewegen (Konvergenzschwäche).
Unterschiedliche Motilitätsuntersuchungen und die Bestimmung der Bereiche, in denen doppelbildfrei mit beiden Augen einfach gesehen wird (Fusionsblickfelder), werden in der Regel apparativ an einem sogenannten Synoptometer oder im freien Raum an der Tangententafel (nach Harms) durchgeführt. Zur Bestimmung der maximalen Bewegungsfähigkeit des rechten und linken Auges (monokulare Exkursionsstrecken) kann auch eine Untersuchung der Folgebewegungen am Goldmann-Perimeter durchgeführt werden. Ein Pinzettenzugtest gibt Aufschluss über die passive Beweglichkeit des Auges.[26] Da es beim Blick entgegengesetzt der Zugrichtung eines fibrosierten Muskels kurzfristig zu einem Anstieg des Augeninnendrucks kommt, kann die Durchführung von Augeninnendruckmessungen in unterschiedlichen Blickrichtungen (Blickrichtungstonometrie) sinnvoll sein. Muskelstrukturen und Dimensionen lassen sich durch bildgebende Verfahren darstellen.[27]
Lider
BearbeitenMeist ist das Oberlid zurückgezogen (Retraktion), was den Eindruck eines starren Blicks erweckt (Kocher-Zeichen[28]). Dabei ist häufig die weiße Augenhaut (Sclera) oberhalb des Übergangs (Limbus) zur Hornhaut sichtbar (Dalrymple-Zeichen[28]), und das Oberlid bleibt bei Blicksenkung zurück (Graefe-Zeichen[28]). Ein seltener Lidschlag (Stellwag-Zeichen[28]) führt oft zu Benetzungsstörungen der Hornhaut sowie zur Austrocknung und einer Chemosis der Bindehaut.[17]
Zur Dokumentation von Verlauf und Status kann die Beurteilung der Lidspaltenweite (Raum zwischen Ober- und Unterlid) und -beweglichkeit mit einem einfachen Lineal erfolgen und wird in Millimeter angegeben. Die Frequenz des Lidschlags drückt man in Anzahl pro Minute aus.
Weitere klinische Zeichen
BearbeitenAls weitere Symptome der endokrinen Orbitopathie gelten Oberlid-Ödem (Enroth-Zeichen[28]), erschwertes Ektropionieren (Gifford-Zeichen[28]), abnorme Oberlidpigmentierung (Jellinek-Zeichen[28]), horizontale Lidfurche (Pocher-Zeichen[28]), fehlendes Stirnrunzeln bei Blickhebung (Joffroy-Zeichen[28]) und Lidzittern bei geschlossenen Lidern (Rodenbach-Zeichen[28]).
Diagnostik
BearbeitenDie Diagnose wird primär klinisch gestellt. Im klassischen Fall tritt der Exophthalmus als Teil der sogenannten Merseburger Trias zusammen mit Schilddrüsenvergrößerung und beschleunigtem Herzschlag im Rahmen eines Morbus Basedow auf.
Weitere diagnostische Maßnahmen dienen primär der Erfassung des Schwere- und Aktivitätsgrades der Krankheit sowie drohender Komplikationen.[29] Insbesondere zur Abschätzung der entzündlichen Aktivität eignet sich die Untersuchung mittels Kernspinresonanzspektroskopie (NMR).[30]
Differentialdiagnostisch ist mittels verschiedener bildgebender Verfahren (Computertomographie, NMR) neben einem hinter dem Auge gelegenen Tumor auch das Krankheitsbild einer okulären Myositis auszuschließen.[17] Nur schwer abzugrenzen von der endokrinen Orbitopathie (Graves ophthalmopathy) sind die – bislang weitgehend unverstandene – Idiopathic orbital inflammation und die isolierte immunogene Orbitopathie. Beide sind letztlich Ausschlussdiagnosen bei fehlendem Nachweis endokriner Beteiligung.[3][31]
Zur Klassifikation von Krankheitsverlauf und -stadium gibt es verschiedene Schemata, von denen sich jedoch bislang keines endgültig als Standard etabliert hat.[3][32] Seit 1969 findet das sogenannte NOSPECS-Schema Anwendung, eine Klassifizierung der American Thyroid Association. Die Buchstabenfolge ist eine spezielle Abkürzung (Akronym) für die englischen Bezeichnungen der abgefragten Symptome. Es ist auch unter dem Namen seines Entwicklers, des US-amerikanischen Arztes Sidney C. Werner, als Werner-Klassifizierung bekannt.[33][34]
Innerhalb dieser Klassifizierung erfolgt eine weitere Einteilung nach den Schweregraden 0, A, B und C, mit denen ein bestimmter Punktwert ermittelt werden kann. Zusammen mit einem weiteren Parameter für die Krankheitsaktivität, dem sogenannten CAS-Score (nach Mourits), wird so der gesamte Krankheitsverlauf bewertet.[12]
Als eine Erweiterung des NOSPECS-Schemas hat sich die sogenannte LEMO-Klassifikation etabliert, die eine sinnvollere und praktikablere Einteilung beinhalten soll und 1991 erstmals von Boergen und Pickardt vorgeschlagen wurde.[29] Hierbei handelt es sich um eine sogenannte Facettenklassifikation.[35] Die Einteilung erfolgt dabei jeweils mit dem vorangestellten Buchstaben und einer folgenden Ziffer. L1E2M0O2 steht beispielsweise für „nur Lidödem, Bindehautreizung morgens, fehlende Muskelveränderungen und periphere Gesichtsfelddefekte“.
Diese Schemata sind vor und während der Behandlung eine wichtige Hilfe, um das Fortschreiten oder auch eine therapiebedingte Besserung des Krankheitsbildes sinnvoll abschätzen zu können. Ergänzend geben sie eine klare Übersicht über die Wertigkeit wichtiger Symptome.
| Klasse | klinische Merkmale | englische Bezeichnung |
|---|---|---|
| 0 | keine Zeichen oder Symptome | No signs or symptoms |
| 1 | Zeichen (z. B. Lidretraktion), keine Symptome | Only signs, no symptoms |
| 2 | Weichteilbeteiligung | Soft tissue involvement |
| 3 | Exophthalmus | Proptosis |
| 4 | Muskelveränderungen | Extraocular muscle involvement |
| 5 | Hornhautkomplikationen | Corneal involvement |
| 6 | Visus- und Gesichtsfeldeinschränkungen | Sight loss |
| Symptome | Klasse | Befund |
|---|---|---|
| Veränderungen an den Lidern (L) |
0 | fehlend |
| 1 | nur Lidödem | |
| 2 | echte Retraktion (beeinträchtigter Lidschluss) | |
| 3 | Retraktion plus Oberlidödem | |
| 4 | Retraktion plus Ober- und Unterlidödem | |
| Exophthalmus (E) | 0 | fehlend |
| 1 | ohne Lidschlussinsuffizienz | |
| 2 | Bindehautreizung morgens | |
| 3 | Bindehautreizung ständig | |
| 4 | Hornhautkomplikationen | |
| Veränderungen an den Muskeln (M) |
0 | fehlend |
| 1 | nur mit bildgebenden Verfahren nachweisbar | |
| 2 | Pseudoparese | |
| 3 | Pseudoparalyse | |
| Beteiligung des N. Opticus (O) |
0 | fehlend |
| 1 | nur im Farbsehen und in VEP | |
| 2 | periphere Gesichtsfelddefekte | |
| 3 | zentrale Gesichtsfelddefekte |
Therapie und Prognose
BearbeitenEine die Ursachen behebende (kausale) Therapie ist bislang nicht bekannt. Es ist jedoch in vielen Fällen möglich, die Symptome zu behandeln. Cortisonpräparate gelten dabei als Mittel der ersten Wahl. In Fällen, in denen ihre Wirkung nicht zufriedenstellend ist, können ergänzende Maßnahmen ergriffen werden, deren Einsatz jedoch wegen noch ausstehender wissenschaftlicher Studien nicht auf der Grundlage empirisch nachgewiesener Wirksamkeit (evidenzbasiert) erfolgt.[36] Die Effektivität der Therapie kann durch die Zusammenarbeit mehrerer medizinischer Fachgebiete (interdisziplinär – Innere Medizin, Strahlentherapie, Augenheilkunde und spezialisiertem Operateur) verbessert werden. In Fällen besonderer psychischer Belastung durch die Erkrankung kann die Unterstützung durch Psychologen hilfreich sein. Trotz fachgerechter Therapie kommt es nur bei 30 % der Patienten zu einer Besserung, bei 60 % ändert sich nichts, und bei 10 % tritt eine Verschlechterung ein.[1][8]
Konservative Behandlung
BearbeitenKonservative Behandlungsmaßnahmen richten sich im Allgemeinen nach Schwere- und Aktivitätsgrad der Krankheit und haben in erster Hinsicht das Ziel, Entzündungsprozesse zu hemmen beziehungsweise zu vermindern. Angaben über die direkte Verbesserung der Augenmotilität durch konservative Behandlungsformen wurden in der Literatur bislang nur wenig gemacht.[27] Zur überbrückenden Behandlung der Doppelbilder können, wenn der Schielwinkel nicht zu groß ist, spezielle Prismenbrillen verwendet werden.[2][27]
Bei etwa der Hälfte aller Patienten mit ausgeprägter endokriner Orbitopathie ist eine psychosomatische Betreuung angezeigt. Grundlegendes Ziel einer Behandlung ist es, neben der Verbesserung der organischen und funktionellen Situation eine bestmögliche Wiederherstellung des äußeren Erscheinungsbildes der Patienten und eine Wiedereingliederung in ihr berufliches und privates Umfeld zu erreichen.[23]
Medikamente
BearbeitenBei leichten Formen, die lediglich mit Trockenheit der Augen oder geringen konjunktivalen Reizzuständen einhergehen, kann eine lokale Behandlung mit Tränenersatzmitteln oder Salben ausreichend sein.[3]
In mittleren bis schweren Fällen, bei denen eine vorhandene oder drohende Beeinträchtigung der Sehkraft besteht, gelten Cortisonpräparate, meist intravenös verabreicht, als Mittel der ersten Wahl.[36] Eine begleitende Behandlung der Schilddrüsenfehlfunktion ist natürlich notwendig.[3][37] Cortisonpräparate haben sich bei aktiven Entzündungsgeschehen wegen ihrer schnellen Wirksamkeit auf Schwellungen bewährt. Bei schweren Krankheitsverläufen kann sich eine intravenöse, hochdosierte Behandlung empfehlen. Jedoch gibt es eine Reihe von Nebenwirkungen (Gewichtszunahme, Stimmungsschwankungen, Magenbeschwerden) und Gegenanzeigen (Diabetes mellitus, Infektionskrankheiten, Psychosen, Magengeschwüre, Osteoporose).[2]
Der monoklonale Antikörper Teprotumumab scheint sehr gut wirksam zu sein, allerdings ist er sehr teuer und noch wenig verfügbar.[38][39] Teprotumumab hemmt die Aktivität des IGF-1-Rezeptors, was das Wachstum der Fibroblasten in der Augenhöhle reduziert.
Kombinationsmöglichkeiten
BearbeitenIn Fällen, in denen die primär eingeleitete Kortisontherapie versagt, besteht bislang kein Konsens über die Art und Weise der optimalen Folgebehandlung. Die Anwendung einer zweiten Kortisonbehandlung mit Bestrahlung oder Cyclosporin erscheint jedoch erfolgversprechend. Die Auswahl ergänzender Verfahren hängt aber von den Erfahrungen der behandelnden Ärzte ab, da in diesem Bereich evidenzbasierte Empfehlungen bislang fehlen.[36]
Vorbeugung bei Radiojodtherapie
BearbeitenPräventiv wird bei Durchführung einer Radiojodtherapie die Gabe von Prednisolon empfohlen. Es ist jedoch umstritten, was eine optimale Dosierung darstellt.[9]
Bestrahlung
BearbeitenDie Bestrahlung wird ergänzend zusammen mit einem weiteren Kortisonschub empfohlen, wenn der erste keinen ausreichenden Erfolg gebracht hat. Evidenzbasierte Empfehlungen fehlen jedoch bislang. Sie wird dabei in Form einer Orbitaspitzenbestrahlung mit einer befundabhängigen Dosis von 2–20 Gy[40][41] durchgeführt. Dies hat den Vorteil, dass im Gegensatz zur Kortisongabe deutlich weniger Nebenwirkungen auftreten. Allerdings ist die Wirkung insgesamt geringer, und ihr Eintritt dauert länger.[2] Neuere Untersuchungen haben ergeben, dass geringere Dosierungen (1 Gy/Woche), gestaffelt über ein längeres Behandlungsintervall (10–20 Wochen), genauso effektiv sein können wie die Verwendung höherer Dosierungen über kürzere Zeiträume (4-mal/Woche 2 Gy bis maximal 12 Gy Gesamtdosis).[36][40]
Botulinumtoxin
BearbeitenAls Behandlung mit beschränkter Wirkdauer kann zur Reduzierung von Doppelbildern oder einer Oberlidretraktion das Nervengift Botulinumtoxin in den betroffenen äußeren Augenmuskel oder den Musculus tarsalis (Müllerscher Muskel – Lidheber) injiziert und so eine vorübergehende Erschlaffung dieser Muskeln erreicht werden. Hierbei darf jedoch noch keine dauerhafte Schädigung der Strukturen durch Fibrosierung eingetreten sein.[27]
Operationen
BearbeitenChirurgische Eingriffe werden erst in der inaktiven, chronisch-fibrotischen Phase der Krankheit durchgeführt und nachdem für einen Zeitraum von wenigsten sechs Monaten ein konstanter Befund bestanden hat.[3] Die Reihenfolge der Maßnahmen, nach der zuerst die Orbita, dann die äußeren Augenmuskeln und zum Schluss die Augenlider operativ behandelt werden, ist einzuhalten. Zwischen den einzelnen Operationen sollten jeweils einige Monate liegen.[11][42]
Orbita
BearbeitenOperationen an der Augenhöhle werden als Entlastungsmaßnahme durchgeführt, um einerseits eine drohende oder bereits eingetretene Einklemmung des Sehnerven zu behandeln. Sie kommen in Betracht, wenn alle konservativen Therapiemöglichkeiten ausgeschöpft sind, oder als Notfallversorgung bei einer akuten Sehnervenquetschung. Andererseits werden sie auch aus kosmetisch-ästhetischen Gründen durchgeführt, um einen auffälligen Exophthalmus zu behandeln und den Augapfel wieder zurück in die Orbita zu positionieren. Hierbei muss die Krankheit jedoch etwa sechs Monate lang einen stabilen Verlauf ohne weiteres Fortschreiten genommen haben und ohne akute entzündliche Prozesse sein.[25]
Es gibt verschiedene Methoden einer Druckentlastung (Dekompression). Entweder wird dabei direkt Fettgewebe entfernt, oder man schafft durch Entfernung der seitlichen oder unteren knöchernen Orbitabegrenzungen Raum, in den sich das Gewebe ausbreiten kann. Dabei sind Beseitigungen der Orbitadecke wegen der unmittelbaren Nähe zum Schädelinneren eher selten.[25] Je nach Zugangsweg zum Operationsgebiet und Technik der angewendeten Verfahren handelt es sich bei operativen Interventionen um einen Augen- und/oder HNO bzw. MKG-chirurgischen Eingriff, kann also eine interdisziplinäre Behandlungsstrategie darstellen.[25]
Wie andere Operationen auch sind Eingriffe zur Orbitadekompression nicht risikolos. In manchen Fällen kann es zu Komplikationen mit Sensibilitätsstörungen im Gesicht kommen oder zu einer verstärkten Schielstellung der Augen. In sehr seltenen Fällen können auch Verletzungen des Auges auftreten.[2]
Augenmuskeln
BearbeitenDas Ziel von Augenmuskeloperationen bei einer endokrinen Orbitopathie ist es, eine Normalisierung der Augenbeweglichkeit mit einem möglichst großen Feld beidäugigen Einfachsehens zu erreichen, und dies ohne Einnahme einer kompensatorischen Kopfzwangshaltung.[25][27] Die Erfolgsrate liegt zwischen etwa 60–80 % einer Doppelbildfreiheit im normalen Gebrauchsblickfeld.[27] Da Schielstellungen und Bewegungseinschränkungen auf eine mangelnde Dehnungsfähigkeit und Strukturveränderungen der Muskeln zurückzuführen sind, können bei solchen Operationen die Verfahrensgrundlagen und Dosierungsrichtlinien normaler Schieloperationen nur sehr eingeschränkt verwendet werden. Welche Muskeln mit welcher Technik letztlich chirurgisch versorgt werden, hängt vom individuellen Krankheitsbild und den jeweiligen Befunden ab. Eine vorsichtige Dosierung ist insbesondere zur Vermeidung von Überkorrekturen notwendig. Aus diesem Grund können gegebenenfalls mehrere Operationen, auch an beiden Augen, durchaus angezeigt sein.
In der Regel wird eine Rücklagerung des fibrotischen Muskels durchgeführt. Dies kann mit und ohne ein festes Wiederannähen (Refixation) des Muskels am Bulbus erfolgen. Im zweiten Fall besteht die Möglichkeit, den Operationseffekt durch Nachjustieren der Fäden bis zum ersten postoperativen Tag noch zu beeinflussen. Als Dosierungsrichtlinie wurde vorgeschlagen, bei der Operation an den vertikalen geraden Augenmuskeln eine Schielwinkelreduzierung von 2° pro Millimeter Muskelrücklagerung zugrunde zu legen, bei der Operation an horizontalen geraden Augenmuskeln 1,7° pro Millimeter Rücklagerungsstrecke. Die Empfehlung reiner Rücklagerungen gilt nicht bei sehr großen Schielwinkeln.[27]
Lider
BearbeitenLidoperationen stehen in der Reihe der chirurgischen Therapiemaßnahmen bei einer endokrinen Orbitopathie zeitlich gesehen an letzter Stelle. Sie können in Frage kommen, wenn dies wegen einer dauerhaften Retraktion des Oberlides, insbesondere auch beim Blick nach unten, aus kosmetisch-ästhetischen Gründen sinnvoll erscheint, oder wenn wegen eines unvollständigen Lidschlusses die Gefahr einer Hornhautaustrocknung besteht.[25]
In der Regel wird ein schwächender Eingriff am Lidheber, dem Musculus levator palpebrae superioris, durchgeführt. Weitere Verfahren sind die Ober- und Unterlidverlängerung und seitliche Lidspaltenverkleinerung.[2]
Gesundheitsökonomische Aspekte
BearbeitenObgleich konkret auf die endokrine Orbitopathie bezogene, gesundheitsökonomische Daten bislang nicht vorliegen, geht man davon aus, dass sie sehr hohe direkte und indirekte Kosten verursacht. Diese sind zum einen bedingt durch die aufwändigen und fachübergreifenden therapeutischen Maßnahmen, den möglicherweise sehr langen oder auch therapieresistenten Krankheitsverläufen, sowie einer entsprechend intensiven Nachsorge. Zum anderen kann es durch Krankschreibungen zu langem Arbeitsausfall bis hin zu dauerhafter Arbeitsunfähigkeit kommen.[23] Dabei wird die Einrichtung spezialisierter Zentren, sowie die verstärkte Forschung, insbesondere auch im genetischen Bereich, als ein Ansatz gesehen, gezieltere und effizientere Behandlungsmaßnahmen zu entwickeln und so für eine Kostenreduzierung zu sorgen, ohne dem primären Ziel der optimalen Patientenversorgung entgegenzuwirken.
Literatur
Bearbeiten- Herbert Kaufmann (Hrsg.): Strabismus. Unter Mitarbeit von Wilfried de Decker u. a. 3., grundlegend überarbeitete und erweiterte Auflage. Georg Thieme, Stuttgart u. a. 2004, ISBN 3-13-129723-9.
- Theodor Axenfeld (Begr.), Hans Pau (Hrsg.): Lehrbuch und Atlas der Augenheilkunde. 12., völlig neu bearbeitete Auflage. Unter Mitarbeit von Rudolf Sachsenweger u. a. Gustav Fischer, Stuttgart u. a. 1980, ISBN 3-437-00255-4.
Weblinks
Bearbeiten- Leitlinie Nr. 28 des Berufsverbandes der Augenärzte Deutschlands (BVA) und der Deutschen ophthalmologischen Gesellschaft (DOG): Orbitaerkrankungen/Exophthalmus
- Katharina A. Ponto, Susanne Pitz, Norbert Pfeiffer, Gerhard Hommel, Matthias M. Weber, George J. Kahaly: Endokrine Orbitopathie – Lebensqualität und berufliche Belastung. (PDF; 372 kB) In: Deutsches Ärzteblatt, Jg. 106, Heft 17, 24. April 2009
- Mitteilung der Deutschen Gesellschaft für Endokrinologie, 27. Jahrgang – Heft 2/2003 (PDF; 1,3 MB)
Einzelnachweise
Bearbeiten- ↑ a b c d Gerd Herold: Innere Medizin 2007. Eine vorlesungsorientierte Darstellung. Eigenverlag, Köln 2007, S. 674–675.
- ↑ a b c d e f g Informationen zur endokrinen Orbitopathie. In: Forschung › Arbeitsgruppe Entzündliche Orbitaerkrankungen. Klinik für Augenheilkunde des Universitätsklinikums Essen, 2023. Auf UK-Essen.de, abgerufen am 10. November 2023.
- ↑ a b c d e f g Albert J. Augustin: Augenheilkunde. 3., komplett überarbeitete und erweiterte Auflage. Springer, Berlin u. a. 2007, ISBN 978-3-540-30454-8, S. 84–85.
- ↑ A. J. Dickinson: Clinical manifestations. In: Wilmar M. Wiersinga, George J. Kahaly (Hrsg.): Graves’ orbitopathy. A multidisciplinary approach. Karger, Basel u. a. 2007, ISBN 978-3-8055-8342-8, S. 1–26.
- ↑ J. Larry Jameson, Anthony P. Weetman (für die deutsche Ausgabe: Jens Zimmermann und George Kahaly): Erkrankungen der Schilddrüse. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.): Harrisons Innere Medizin. 15. Auflage, deutsche Ausgabe, Sonderausgabe. Lehmanns Media LOB.de u. a., Berlin u. a. 2003, ISBN 3-936072-10-8.
- ↑ Jörg Rüdiger Siewert, Matthias Rothmund, Volker Schumpelick (Hrsg.): Praxis der Viszeralchirurgie. Endokrine Chirurgie. Springer Medizin, Berlin u. a. 2007, ISBN 978-3-540-22717-5, S. 42.
- ↑ G. B. Bartley, V. Fatourechi, E. F. Kadrmas, S. J. Jacobsen, D. M. Ilstrup, J. A. Garrity, C. A. Gorman: Chronology of Graves’ ophthalmopathy in an incidence cohort. In: American Journal of Ophthalmology. Band 121, Nr. 4, 1996, ISSN 0002-9394, S. 426–434, PMID 8604736.
- ↑ a b c d J. Hädecke, U. Schneyer: Endokrinologische Befunde bei der endokrinen Orbitopathie. In: Klinische Monatsblätter für Augenheilkunde, Band 222, Nr. 1, 2005, ISSN 0023-2165, S. 15–18, doi:10.1055/s-2004-813646.
- ↑ a b Sally R. James, Aaron M. Ranasinghe, Rajamiyer Venkateswaran, Christopher J. McCabe, Jayne A. Franklyn, Robert S. Bonser: Lower Dose Prednisone Prevents Radioiodine-Associated Exacerbation of Initially Mild or Absent Graves’ Orbitopathy: A Retrospective Cohort Study. In: The Journal of Clinical Endocrinology and Metabolism, Band 95, Nr. 3, 2010, ISSN 0021-972X, S. 1333–1337, doi:10.1210/jc.2009-2130, PMID 20061414.
- ↑ Katharina A. Ponto, George J. Kahaly: Endokrine Orbitopathie – Aktuelle Diagnostik und Therapie. In: Medizinische Klinik, Band 103, Nr. 10, 2008, ISSN 0723-5003, S. 717–730, doi:10.1007/s00063-008-1112-1, zitiert nach Katharina A. Ponto, Susanne Pitz, Norbert Pfeiffer, Gerhard Hommel, Matthias M. Weber, George J. Kahaly: Endokrine Orbitopathie: Lebensqualität und berufliche Belastung. In: Deutsches Ärzteblatt International, Band 106, Nr. 17, 2009, ISSN 1866-0452, S. 283–289, doi:10.3238/arztebl.2009.0283.
- ↑ a b U. Hennighausen: Zur Jahrestagung der Sächsischen Augenärztlichen Gesellschaft. Über die konservative Therapie der endokrinen Orbitopathie. In: Der Augenspiegel. Forum der Augenärzte, Band 55, Nr. 4, ISSN 0004-7937, S. 8 ff.
- ↑ a b A. Eckstein, M. Plicht, N. Morgenthaler, K. P. Steuhl, K. Renzing-Köhler, B. Quadbeck, K. Mann, J. Esser: Die TSH-Rezeptor Antikörper helfen die Prognose einer endokrinen Orbitopathie einzuschätzen. ( des vom 28. August 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. 101. Jahrestagung der DOG (Deutschen ophthalmologischen Gesellschaft) 2003.
- ↑ Suche nach „Graves“. In: Fritz-Jürgen Nöhring: Fachwörterbuch Medizin. Deutsch – Englisch. 3., stark bearbeitete und erweiterte Auflage. Langenscheidt u. a., Berlin u. a. 2003, ISBN 3-86117-185-6.
- ↑ R. J. Graves: New observed affection of the thyroid gland in females. (Clinical lectures). In: The London Medical and Surgical Journal. NS Bd. 7, 1835, ZDB-ID 422792-x, S. 516–517; Reprinted in Medical Classics, Band 5, 1940/1941, ZDB-ID 604496-7, S. 33–36.
- ↑ Anja K. Eckstein, Marco Plicht, Hildegard Lax, Herbert Hirche, Beate Quadbeck, Klaus Mann, Klaus P. Steuhl, Joachim Esser, Nils G. Morgenthaler: Clinical results of anti-inflammatory therapy in Graves’ ophthalmopathy and association with thyroidal autoantibodies. In: Clinical Endocrinology, Band 61, Nr. 5, November 2004, ISSN 0300-0664, S. 612–618, doi:10.1111/j.1365-2265.2004.02143.x, PMID 15521965.
- ↑ a b Anja K. Eckstein, Kristian T. M. Johnson, M. Thanos, Joachim Esser, Marian Ludgate: Current insights into the pathogenesis of Graves’ orbitopathy. In: Hormone and Metabolic Research. Band 41, Nr. 6, 2009, ISSN 0018-5043, S. 456–464, doi:10.1055/s-0029-1220935, PMID 19530272.
- ↑ a b c d e f Franz Grehn: Augenheilkunde. 30., überarbeitete und aktualisierte Auflage. Springer, Heidelberg 2008, ISBN 978-3-540-75264-6, S. 324–325.
- ↑ Hanns Kaiser, Hans K. Kley: Cortisontherapie. Corticoide in Klinik und Praxis. 11., neu bearbeitete Auflage. Georg Thieme, Stuttgart u. a. 2002, ISBN 3-13-357211-3, S. 267–268.
- ↑ a b Kai Joachim Bühling, Julia Lepenies, Karsten Witt: Intensivkurs: Allgemeine und spezielle Pathologie. 3., aktualisierte und erweiterte Auflage. Elsevier, Urban & Fischer Verlag, München u. a. 2004, ISBN 3-437-42411-4, S. 249.
- ↑ a b G. Kommerell: Endokrine Orbitopathie. In: Herbert Kaufmann (Hrsg.): Strabismus. Unter Mitarbeit von Wilfried de Decker u. a. Enke, Stuttgart 1986, ISBN 3-432-95391-7, S. 395–397, hier S. 396.
- ↑ Endokrine Orbitopathie. In: Roche Lexikon Medizin; abgerufen am 20. Juni 2013.
- ↑ I. Coulter, S. Frewin, G. E. Krassas, P. Perros: Psychological implications of Graves’ orbitopathy. In: European Journal of Endocrinology, Band 157, Nr. 2, 2007, ISSN 0804-4643, S. 127–131, doi:10.1530/EJE-07-0205.
- ↑ a b c Katharina A. Ponto, Susanne Pitz, Norbert Pfeiffer, Gerhard Hommel, Matthias M. Weber, George J. Kahaly: Endokrine Orbitopathie: Lebensqualität und berufliche Belastung. In: Deutsches Ärzteblatt International, Band 106, Nr. 17, 2009, S. 283–289, doi:10.3238/arztebl.2009.0283.
- ↑ Peter Berlit (Hrsg.): Klinische Neurologie. Springer, Berlin u. a. 1999, ISBN 3-540-65281-7, S. 376–378.
- ↑ a b c d e f Operative und nichtoperative Behandlungsmöglichkeiten ( des vom 16. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. bei basedow.ch (interdisziplinäre Gruppe von Spezialärzten öffentlicher Spitäler und privater Kliniken, Schweiz)
- ↑ Leitlinie Nr. 28 des Berufsverbands der Augenärzte Deutschlands, BVA, zu Orbitaerkrankungen / Exophthalmus
- ↑ a b c d e f g Herbert Kaufmann (Hrsg.): Strabismus. 3., grundlegend überarbeitete und erweiterte Auflage. 2004, S. 428 ff.
- ↑ a b c d e f g h i j Theodor Axenfeld (Begr.), Hans Pau (Hrsg.): Lehrbuch und Atlas der Augenheilkunde. 12., völlig neu bearbeitete Auflage. 1980.
- ↑ a b E. Heufelder, D. Schworm, C. Hofbauer: Die endokrine Orbitopathie: Aktueller Stand zur Pathogenese, Diagnostik und Therapie. In: Deutsches Ärzteblatt, Band 93, Nr. 20, 1996, S. A-1336–A1342.
- ↑ Eberhard Kirsch, Beat Hammer, Georg von Arx: Graves’ orbitopathy: current imaging procedures. In: Swiss Medical Weekly, Band 31, Nr. 43/44 = Nr. 139, Oktober 2009, ISSN 1424-7860, S. 618–623, online (PDF; 526 KB) ( des vom 16. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF), PMID 19950023.
- ↑ Ward R. Bijlsma, Rachel Kalmann: Idiopathic Orbital Inflammation and Graves Ophthalmopathy. In: Archives of Ophthalmology, Band 128, Nr. 1, 2010, ISSN 0003-9950, S. 131–132, doi:10.1001/archophthalmol.2009.324.
- ↑ K. P. Boergen, C. R. Pickardt: Neueinteilung der endokrinen Orbitopathie. In: Die Medizinische Welt, Band 42, 1991, ISSN 0025-8512, S. 72–76.
- ↑ Navid Ardjomand, Gertrud Esche, Susanne Lindner, Manuela Panzitt, Reingard Aigner, Andrea Berghold, Andrea Langmann: Die Bedeutung der Oktreotidszintigraphie bei der Diagnostik der aktiven endokrinen Orbitopathie. In: Spektrum der Augenheilkunde, Band 15, Nr. 3, 2001, ISSN 0930-4282, S. 113–116, doi:10.1007/BF03162928.
- ↑ Georg J. Kahaly, Peter Bumb, Susanne Pitz, Christoph Scheurle, Katharina A. Ponto, Kathrin Lingl, Gerhard Hommel, Wibke Müller-Forell, Matthias M. Weber, Wolf J. Mann: Operative Entlastung bei endokriner Orbitopathie. In: Medizinische Klinik, Band 102, Nr. 9, 2007, ISSN 0723-5003, S. 714–719, doi:10.1007/s00063-007-1097-1.
- ↑ K.-P. Boergen: Ophthalmological diagnosis in autoimmune orbitopathy. In: Experimental and Clinical Endocrinology & Diabetes, Band 97, Nr. 2/3, 1991, ISSN 0947-7349, S. 235–242, doi:10.1055/s-0029-1211071.
- ↑ a b c d L. Bartalena: What to do for moderate-to-severe and active Graves’ orbitopathy if glucocorticoids fail?. In: Clin Endocrinol. (Oxf). 2010 Feb 10, PMID 20148907.
- ↑ Jack J. Kanski: Klinische Ophthalmologie. Lehrbuch und Atlas. 6., aktualisierte und erweiterte Auflage. Elsevier, Urban & Fischer, München u. a. 2008, ISBN 978-3-437-23471-2, S. 174–176.
- ↑ Luigi Bartalena: Role of teprotumumab in the treatment of active moderate-to-severe Graves’ orbitopathy. In: European Thyroid Journal. Band 11, Nr. 6, 8. Dezember 2022, ISSN 2235-0640, S. e220185, doi:10.1530/ETJ-22-0185, PMID 36479873.
- ↑ Shoaib Ugradar, Julia Kang, Andrea L. Kossler, Erin Zimmerman, Jenna Braun, Andrew R. Harrison, Swaraj Bose, Kimberly Cockerham, Raymond S. Douglas: Teprotumumab for the treatment of chronic thyroid eye disease. In: Eye. Band 36, Nr. 8, August 2022, ISSN 1476-5454, S. 1553–1559, doi:10.1038/s41433-021-01593-z (nature.com [abgerufen am 28. Juni 2024]).
- ↑ a b Kristian T. M. Johnson, Andrea Wittig, Christian Loesch, Joachim Esser, Werner Sauerwein, Anja K. Eckstein: A retrospective study on the efficacy of total absorbed orbital doses of 12, 16 and 20 Gy combined with systemic steroid treatment in patients with Graves’ orbitopathy. In: Graefe’s Archive for Clinical and Experimental Ophthalmology, Band 248, Nr. 1, 2010, ISSN 0721-832X, S. 103–109, doi:10.1007/s00417-009-1214-3, PMID 19865824.
- ↑ L. Bartalena1, G. J. Kahaly, L. Baldeschi, C. M. Dayan, A. Eckstein, C. Marcocci, M. Marinò, B. Vaidya, W. M. Wiersinga: The 2021 European Group on Graves’ orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves’ orbitopathy. In: European Journal of Endocrinology. Band 185, Nr. 4, Oktober 2021, S. G43–G67, doi:10.1530/EJE-21-0479, PMID 34297684 (englisch).
- ↑ Chirurgische Sanierung bei endokriner Orbitopathie. (PDF; 2,9 MB) Forum Schilddrüse e. V.