Niob(V)-ethoxid
Niob(V)-ethoxid ist eine chemische Verbindung des Niobs aus der Gruppe der Ethanolate.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
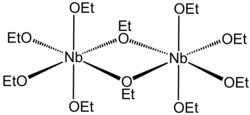
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Niob(V)-ethoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H25NbO5 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 318,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,258 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,5160 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenNiob(V)-ethoxid kann durch Reaktion von Niob(V)-chlorid mit Ethanol in Gegenwart von Ammoniak gewonnen werden.[3][4] Die Verbindung kann auch elektrochemisch direkt aus Niob gewonnen werden.[5]
Eigenschaften
BearbeitenNiob(V)-ethoxid ist eine farblose bis bernsteinfarbene Flüssigkeit, die löslich in organischen Lösungsmitteln ist. In Wasser erfolgt Zersetzung.[1][2]
Verwendung
BearbeitenNiob(V)-ethoxid wird zur Herstellung von Niob(V)-oxid und Metallmischoxiden verwendet. Es wird auch für die Sol-Gel-Verarbeitung von Materialien eingesetzt, die Nioboxide und Metallmischoxide enthalten. Daneben dient es zur Herstellung ferroelektrischer Nanomaterialien, die aus Oxiden von Kalium, Silizium und Niob bestehen.[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k l Datenblatt Niobium(V) ethoxide, 99.999% (metals basis), Ta <500ppm bei Alfa Aesar, abgerufen am 29. März 2020 (Seite nicht mehr abrufbar).
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 76 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Google Patents: US20020143200A1 - Process for preparing tantalum alkoxides and niobium alkoxides - Google Patents, abgerufen am 29. März 2020
- ↑ D. C. Bradley, B. N. Chakravarti, W. Wardlaw: 460. Normal alkoxides of quinquevalent niobium. In: Journal of the Chemical Society. 1956, S. 2381, doi:10.1039/JR9560002381.
- ↑ Ya-nan Cai, Sheng-hai Yang u. a.: Electrochemical synthesis, characterization and thermal properties of niobium ethoxide. In: Journal of Central South University of Technology. 18, 2011, S. 73, doi:10.1007/s11771-011-0661-2.

