Monosaccharide
Monosaccharide (altgr. μόνος mónos 'allein', τό σάκχαρ tó sákchar 'Zucker' und -ειδής -eidés 'artig, förmig' auch Einfachzucker genannt) sind eine Stoffgruppe von organisch-chemischen Verbindungen. Sie sind die Produkte der partiellen Oxidation mehrwertiger Alkohole. Monosaccharide haben eine Kette aus mindestens zwei Kohlenstoffatomen als Grundgerüst und weisen eine Carbonylgruppe sowie mindestens eine Hydroxygruppe auf. Sie sind die Bausteine aller Kohlenhydrate und können sich zu Disacchariden (Zweifachzuckern), Oligosacchariden (Mehrfachzuckern) oder Polysacchariden (Vielfachzuckern) verbinden.

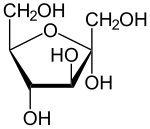
Die Monosaccharide Glucose, Fructose und Galactose sind die wichtigsten Zucker des Stoffwechsels. Sie sind Energieträger und dienen auch als Zellbausteine.
Aufbau
BearbeitenJeder Einfachzucker besteht aus einer Kette von Kohlenstoff-Atomen. Die Kette kann offen (nichtcyclisch) oder ringförmig geschlossen (cyclisch) sein.
Nach der Anzahl der Kohlenstoffatome spricht man von Diosen (2), Triosen (3), Tetrosen (4), Pentosen (5), Hexosen (6), Heptosen (7). Octosen (8), Nonosen (9) usw. Die kleinsten Einfachzucker, die Triosen, haben also drei Kohlenstoffatome. Prinzipiell ist die Länge der Kohlenstoffkette unbegrenzt, in der Natur wurden bisher aber nur Einfachzucker mit maximal neun Kohlenstoffatomen beobachtet, wobei Hexosen und Pentosen am häufigsten zu finden sind.
Des Weiteren befindet sich an einem der Kohlenstoffatome der nichtcyclischen (offenkettigen) Form ein doppelt gebundenes Sauerstoff-Atom, also eine Carbonylgruppe. Befindet sich die Carbonylgruppe am Ende der Kohlenstoffkette, bezeichnet man die Gruppe als Aldehydgruppe und den Zucker als Aldose, bei einer Carbonylgruppe innerhalb der Kette von einer Ketogruppe und bei dem Zucker von Ketosen.
Beide Nomenklaturen lassen sich gemeinsam anwenden, sodass man bei einem Einfachzucker mit sechs Kohlenstoffatomen und einer Aldehydgruppe von einer Aldohexose spricht.
Zu jedem offenkettigen Monosaccharid ausreichender Länge gibt es cyclische Formen, wobei der Ringschluss von der Carbonylgruppe zu einer Hydroxygruppe (OH-Gruppe) erfolgt. Der Ring besteht somit aus Kohlenstoffatomen und einem Sauerstoffatom. Dabei unterscheidet man Furanosen (Fünfringe) und Pyranosen (Sechsringe). Von Aldosen abgeleitete cyclische Monosaccharide sind Halbacetale, von Ketosen abgeleitete Halbketale.
Bei den einfachsten Vertretern der Monosaccharide tragen die übrigen Kohlenstoffatome ohne Carbonylgruppe jeweils eine Hydroxygruppe (OH-Gruppe) und ansonsten Wasserstoffatome. Für diese Verbindungen gilt die allgemeine Summenformel: CnH2nOn.
Jedoch zählen auch Derivate dieser einfachen Verbindungen zu den Monosacchariden, wie Aminozucker (z. B. Glucosamin) und Desoxyzucker (z. B. Desoxyribose). Sie entsprechen nicht dieser allgemeinen Summenformel.
Räumliche Struktur
BearbeitenNeben der Position der Carbonylgruppe (Oxogruppe) in der Kohlenstoffkette spielt auch die räumliche Anordnung der OH-Gruppen eine wichtige Rolle. Bei einer Aldohexose beispielsweise sind vier der Kohlenstoffatome je nach einer 'rechts' oder 'links' angebrachten OH-Gruppe unterscheidbar. Insgesamt gibt es somit 16 (24 = 16) verschiedene Stereoisomere einer Aldohexose, die sich im Stoffwechsel und in der optischen Aktivität unterscheiden. Ferner verfünffacht sich die Anzahl der theoretisch möglichen Stereoisomere noch, da zusätzlich zur offenkettigen Form durch intramolekulare Ausbildung eines cyclischen Halbacetals die Furanose- oder Pyranose-Form mit α- bzw. β-Konfiguration entstehen kann.
Die stereochemische Darstellung kann auf drei gleichberechtigte Arten erfolgen. Die älteste Darstellung ist die Fischer-Projektion, bei der sämtliche C–C-Bindungen in gedachter (thermodynamisch ungünstigster) eclipsed-Stellung senkrecht übereinander und auf der Papierebene ausgerollt geschrieben werden. Die Substituenten, hier Wasserstoffatome und Hydroxy-Gruppen, werden je nach Konfiguration rechts bzw. links aufgeführt und stehen oberhalb der Papierebene, so dass sich eine eindeutige Konfiguration ergibt. Die Hydroxygruppe des am weitesten vom anomeren C-Atom entfernten chiralen C-Atoms bildet in Rechtsstellung die D-Konfiguration, in Linksstellung die L-Konfiguration (siehe am Beispiel von D- und L-Ribose oben).
Das cyclische Halbacetal ist in der auch Tollens-Ringformel genannten Darstellung (1) unübersichtlich und es werden überlange Bindungen erforderlich. Daher wurden weitere Darstellungen entwickelt. Die Haworth-Darstellung (2) entspricht einer „auf die Seite gelegten“ und aufgerollten Fischer-Projektion. Alle Ringatome befinden sich auf einer Ebene, der räumliche Eindruck kann durch perspektivische Bindungen verstärkt werden. Die Bindung eines Substituenten nach „oben“ soll kenntlich machen, dass dieser oberhalb der Ringebene liegt. Die in der Fischer-Projektion nach links (bzw. rechts) weisenden Gruppen zeigen am Haworth-Ring nach oben (bzw. unten).
Noch realistischer ist die Konformationsformel (3), da hierbei die gewinkelte Anordnung der Kohlenstoffkette erkennbar ist. Auch die stereochemische Darstellung (4) ist üblich.
Wichtige Monosaccharide
BearbeitenStammbaum der Aldosen
Bearbeiten(1) D-(+)-Glycerinaldehyd;
(2a) D-(−)-Erythrose; (2b) D-(−)-Threose;
(3a) D-(−)-Ribose; (3b) D-(−)-Arabinose; (3c) D-(+)-Xylose; (3d) D-(−)-Lyxose;
(4a) D-(+)-Allose; (4b) D-(+)-Altrose; (4c) D-(+)-Glucose; (4d) D-(+)-Mannose; (4e) D-(−)-Gulose; (4f) D-(−)-Idose; (4g) D-(+)-Galactose; (4h) D-(+)-Talose
Stammbaum der Ketosen
Bearbeiten(1) Dihydroxyaceton;
(2) D-Erythrulose;
(3a) D-Ribulose; (3b) D-Xylulose;
(4a) D-Psicose; (4b) D-Fructose; (4c) D-Sorbose; (4d) D-Tagatose
Glycolaldehyd (2-Hydroxyethanal).
- Aldotriose
- D- und L-Glycerinaldehyd (Stoffwechselprodukte)
- Ketotriose
- Aldotetrose
- Ketotetrose
- D-Erythrulose (Stoffwechselprodukt)
- Aldopentose
- D-Ribose (kommt u. a. in der RNA vor)
- D- und L-Arabinose (kommen u. a. in pflanzlichen Oligosacchariden vor)
- D-Xylose (auch Holzzucker, Hauptbestandteil der Hemicellulosen)
- D-Lyxose (kommt in der Natur nicht vor)
- D-Desoxyribose (kommt u. a. in der DNA vor)
- Ketopentose
- D-Ribulose (Stoffwechselprodukt)
- D- und L-Xylulose (erstere ist Teil des Pentosephosphatweges, letztere des Glucuronat-Stoffwechsels)
- Aldohexosen
- D-Allose (sehr selten in der Natur)
- D-Altrose (in der Natur nicht gefunden, L-Altrose wurde in einer Bakterie gefunden[1])
- D-Glucose (auch Traubenzucker, häufigstes Monosaccharid)
- D-Mannose (häufiges Monosaccharid)
- D-Gulose (selten in der Natur, meist in L-Form)
- D-Idose (kommt in der Natur nicht vor, aber die entsprechende Uronsäure, Iduronsäure, kommt vor allem in Glykosaminoglykanen vor)
- D-Galactose (auch Schleimzucker, häufiges Monosaccharid)
- D-Talose (sehr selten, Bestandteil der von Streptomyceten gebildeten antibiotisch wirkenden Hygromycine)
- weitere physiologisch bedeutsame Hexosen
- D-Glucuronsäure (6-Carboxy-D-glucose, häufig, liegt meist als Glucuronat oder verestert vor)
- D-Galacturonsäure (6-Carboxy-D-galactose, liegt meist als Uronat oder verestert vor)
- N-Acetyl-D-glucosamin (auch N-Acetylchitosamin, Monomer des Chitins, kommt weit verbreitet vor)
- D-Glucosamin (auch Chitosamin, Monomer des Chitosans)
- N-Acetyl-D-galactosamin (auch N-Acetylchondrosamin, kommt weit verbreitet vor)
- D- und besonders L-Fucose (6-Desoxy-D- und -L-galactose, letztere kommt weit verbreitet vor)
- L-Rhamnose (6-Desoxy-L-mannose, kommt in pflanzlichen Oligosacchariden vor)
- D-Chinovose (6-Desoxy-D-glucose, kommt z. B. in pflanzliche Oligosacchariden vor)
- Ketohexosen
- D-Fructose (auch Fruchtzucker, häufiges Monosaccharid)
- Seltene Hexosen
Höhere Monosaccharide
Bearbeiten- D-Sedoheptulose (ein C7-Ketozucker, ist als 7-Phosphat am Pentosephosphatweg beteiligt)
- 3-Desoxy-D-manno-oct-2-ulosonsäure (auch 2-Keto-3-desoxyoctonsäure, KDO, ein C8-Zucker, wichtiger Bestandteil von Lipopolysacchariden der Zelloberfläche bestimmter Bakterien)
- D-Sialinsäure (auch N-Acetylneuraminsäure, ein C9-Ketozucker, spielt bei der Zell-Zell-Erkennung in Glycokonjugaten eine Rolle)
Photosynthese
BearbeitenDer Ausgangspunkt der meisten Einfachzucker in Lebewesen ist die oxygene Photosynthese. Während dieses Prozesses wird unter Nutzung der Sonnenenergie aus CO2 (Kohlenstoffdioxid) und den im H2O (Wasser) enthaltenen Wasserstoffatomen Zucker aufgebaut. Bei der dazu erforderlichen Wasserspaltung wird als Abfallprodukt Sauerstoff freigesetzt.
Einfachzucker in Lebensmitteln
BearbeitenEinfachzucker befinden sich als Glucose (Traubenzucker) und Fructose (Fruchtzucker) in Lebensmitteln wie Obst, Honig und Süßigkeiten. Auch die Galactose, der sogenannte Schleimzucker in der Milch, ist ein Einfachzucker. Demgegenüber sind Rohr-, Milch- oder Malzzucker Zweifachzucker; Stärke und Glykogen sind Vielfachzucker. Alle höheren Zucker müssen zuerst zu wasserlöslichen Di- oder Monosacchariden abgebaut werden, um über Transportproteine – wie die Glucosetransporter – oder einfache Diffusion ins Blut aufgenommen bzw. in die Leber transportiert werden zu können.
Die orale Aufnahme der Monosaccharide Glucose und Galactose führt zu einem raschen Anstieg des Blutzuckerspiegels; alle anderen Einfachzucker werden vorwiegend in der Leber verstoffwechselt und haben keine direkte Wirkung auf den Glucosespiegel im Blut.[2] Da der Blutzuckerspiegel eine enge Schwankungsbreite aufweisen muss, ist es für den Organismus erforderlich, dem schnellen Anstieg durch rasche Weiterverarbeitung entgegenzuwirken. Der Insulinspiegel steigt an und der Blutzucker wird in der Leber in Glykogen – ein Polysaccharid aus Glucose-Bausteinen – umgewandelt. Dies erzeugt einen schnellen Energiespeicher in der Leber, da das Glycogen bei Bedarf rasch wieder in Glucose zerlegt werden kann.[3] Überschüssige Glucose, die nicht als Glycogen gespeichert werden kann, wird im Fettgewebe und der Leber in Triacylglycerine (Fette) umgewandelt, die in Leber, Skelettmuskulatur und Fettzellen als Energiedepot dienen.[4]
Ernährungswissenschaftler empfehlen, maximal 10 % der Gesamtenergiemenge durch Einfach- und Zweifachzucker aufzunehmen. Vielfachzucker wie v. a. Stärke gelten als besser geeignet, den Kohlenhydratbedarf zu decken, da sie im Magen-Darm-Trakt zunächst zu Einfachzuckern umgewandelt werden müssen, was zu einer deutlich langsameren Aufnahme der Kohlenhydrate führt.[5]
Literatur
Bearbeiten- Gerhard Richter: Stoffwechselphysiologie der Pflanzen. Physiologie und Biochemie des primär- und Sekundärstoffwechsels. 6., völlig neubearbeitete Auflage. Georg Thieme, Stuttgart u. a. 1998, ISBN 3-13-442006-6, S. 213–223 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Espacenet – Bibliographic data. Abgerufen am 18. November 2018 (englisch).
- ↑ Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer, Berlin u. a. 2008, ISBN 978-3-540-73201-3, S. 895.
- ↑ Georg Löffler, Petro E. Petrides, Peter C. Heinrich (Hrsg.): Biochemie und Pathobiochemie. 8., völlig neu bearbeitete Auflage. Springer Medizin, Heidelberg 2007, ISBN 978-3-540-32680-9.
- ↑ Hermann Hager (Begründer), Hubert Schneemann, Gisela Wurm: Hagers Handbuch der pharmazeutischen Praxis. Folgewerk, Folgeband 1: Waren und Dienste. 5., vollständig neubearbeitete Auflage. Springer, Berlin u. a. 1995, ISBN 3-540-58958-9, S. 18.
- ↑ Bericht der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen: Diet, Nutrition and the Prevention of Chronic Diseases (Tabelle 6)