Ytterbium(III)-chlorid
Ytterbium(III)-chlorid ist eine anorganische chemische Verbindung des Ytterbiums und zählt zu den Chloriden. Neben diesem ist mit Ytterbium(II)-chlorid ein weiteres Ytterbiumchlorid bekannt.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Yb3+ _ Cl− | ||||||||||
| Allgemeines | ||||||||||
| Name | Ytterbium(III)-chlorid | |||||||||
| Verhältnisformel | YbCl3 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,57 g·cm−3[3] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1900 °C[4] | |||||||||
| Löslichkeit |
löslich in Wasser[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Gewinnung und Darstellung
BearbeitenYtterbiumchlorid wird durch Reaktion von Ytterbium(III)-oxid entweder mit Tetrachlorkohlenstoff[5] oder heißer Salzsäure hergestellt.[6]
Die wasserfreie Verbindung wird durch Erhitzen der wasserhaltigen Verbindung im HCl-Strom bei langsam ansteigender Temperatur dargestellt. Bei 350 °C ist die Substanz wasserfrei.[7]
Eigenschaften
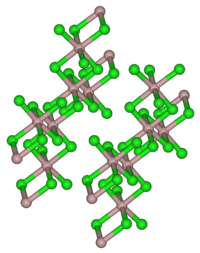
BearbeitenYtterbium(III)-chlorid kristallisiert in einer kubischen Aluminiumchlorid-Schichtstruktur. In der Gasphase bilden sich kleinere Einheiten wie [YbCl6]3−[8] oder Yb2Cl6[9].
Verwendung
BearbeitenKatalysator in der organischen Chemie
BearbeitenYtterbium(III)-chlorid wirkt auf Grund des einzelnen ungepaarten f-Elektrons als Lewis-Säure. Dies ermöglicht der Verbindung, in Übergangszuständen Komplexe zu bilden und so Alkylierungsreaktionen, wie Aldolreaktionen[10] und die Pictet-Spengler-Reaktion[11] zu katalysieren.
- Aldol-Reaktion
Bei der Aldolreaktion dient Ytterbium(III)-chlorid als Hilfs-Katalysator bei der palladium-katalysierten decarboxylierenden Aldolreaktion eines Enolates mit einem Aldehyd. Die Übergangszustände A und B zeigen die Koordinierung des Ytterbiumsalzes. Für die oben beschriebene decarboxylierende Aldolreaktion mit R = tert-Butyl und R' = –(CH2)2Ph zeigt der Vergleich der Ausbeuten von verschiedenen Lewis-Säuren eine besonders hohe Ausbeute bei Ytterbium(III)-chlorid.[10]
| Salz[10] | % Ausbeute von 2 |
|---|---|
| Eisen(III)-chlorid | 40 |
| Zinkchlorid | 68 |
| Kupfer(II)-chlorid | 40 |
| Lanthan(III)-chlorid | 60 |
| Ytterbium(III)-chlorid | 93 |
- Pictet-Spengler-Reaktion
Ytterbium(III)-chlorid katalysiert als Lewis-Säure die Pictet-Spengler-Reaktion zur Gewinnung von Tetrahydro-Beta-Carbolinen, aus denen synthetische Indolalkaloide hergestellt werden. Dabei ermöglicht es hohe Ausbeuten und reduziert die Reaktionszeit von Tagen zu 24 Stunden.[11]
- Esterbildung
Die geringe Größe des Yb3+-Ions ermöglicht eine schnelle Katalyse, jedoch ist die Selektivität gering. Beispielsweise ist die Mono-Acetylierung von meso-1,2-Diolen mit zwei Stunden am schnellsten mit Ytterbium(III)-chlorid, die Chemoselektivität für das monoacetylierte Produkt ist dagegen mit 50 % gering im Vergleich zu Cer(III)-chlorid (23 h Reaktionszeit, 85 %).[12]
- Acetalbildung
Acetalbildung eines säureempfindlichen Aldehyds mit Trimethylorthoformiat und Ytterbium(III)-chlorid als Katalysator
Ytterbium(III)-chlorid ist ein starker Katalysator für die Acetalbildung mit Trimethylorthoformiat. Im Vergleich mit Cer(III)-chlorid und Erbium(III)-chlorid ist das Ytterbiumsalz am effektivsten. Es erzielt hohe Ausbeuten in einer schnellen Reaktion bei Raumtemperatur bei einer Vielzahl an Aldehyden.[13]
NMR-Shift-Reagenz
BearbeitenYtterbium kann als NMR-Shift-Reagenz, etwa in der Membranbiologie für die Verfolgung der Bewegungen von 39K+ und 23Na+, die bei Nervensignalen eine wichtige Rolle spielen, verwendet werden.[14]
Einzelnachweise
Bearbeiten- ↑ a b c Datenblatt Ytterbium(III)-chlorid bei Alfa Aesar, abgerufen am 28. Februar 2012 (Seite nicht mehr abrufbar).
- ↑ Datenblatt Ytterbium(III) chloride hexahydrate, 99.9999% trace metals basis bei Sigma-Aldrich, abgerufen am 25. März 2012 (PDF).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-99.
- ↑ a b John Harris, Walter Benenson, Horst Stöcker: Handbook of physics. Springer, 2002, ISBN 0-387-95269-1, S. 781 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ V.F. Goryushkin, S.A. Zalymova, A.I. Poshevneva. In: Russ. J. Inorg. Chem. 1990, 35, 12, S. 1749–1752.
- ↑ Joerg Sebastian, Hans-Joachim Seifert: Ternary chlorides in the systems ACl/YbCl3 (A=Cs,Rb,K). In: Thermochimica Acta. 318, 1998, S. 29–37, doi:10.1016/S0040-6031(98)00326-8.
- ↑ G. Jantsch, N. Skalla, H. Jawurek: „Zur Kenntnis der Halogenide der seltenen Erden. V. – Über die Halogenide des Ytterbiums“, in: Zeitschrift für anorganische und allgemeine Chemie, 1931, 201, S. 207–220; doi:10.1002/zaac.19312010119.
- ↑ Wei-Jyh Gau: Electrochemical and Spectroscopic Studies of Ytterbium in the Aluminum Chloride-1-methyl-3-ethylimidazolium Chloride Room Temperature Molten Salt. In: Journal of The Electrochemical Society. 143, 1996, S. 170–174, doi:10.1149/1.1836403.
- ↑ A. D. Chervonnyi, N. A. Chervonnaya: Thermodynamic Properties of Ytterbium Chlorides. In: Russian Journal of Inorganic Chemistry. 2004, 49, 12, S. 1889–1897 (Abstract ( vom 4. März 2016 im Internet Archive)).
- ↑ a b c Sha Lou, John A. Westbrook, Scott E. Schaus: Decarboxylative Aldol Reactions of Allyl β-Keto Esters via Heterobimetallic Catalysis. In: Journal of the American Chemical Society. 126, 2004, S. 11440–11441, doi:10.1021/ja045981k.
- ↑ a b Natarajan Srinivasan, A. Ganesan: Highly efficient Lewis acid-catalysed Pictet-Spengler reactions discovered by parallel screening. In: Chemical Communications., S. 916–917, doi:10.1039/B212063A.
- ↑ Paul A. Clarke: Selective mono-acylation of meso- and C2-symmetric 1,3- and 1,4-diols. In: Tetrahedron Letters. 43, 2002, S. 4761–4763, doi:10.1016/S0040-4039(02)00935-8.
- ↑ Jean-Louis Luche, André Luis Gemal: Efficient synthesis of acetals catalysed by rare earth chlorides. In: Journal of the Chemical Society, Chemical Communications. 1978, S. 976, doi:10.1039/c39780000976.
- ↑ Manajit K. Hayer, Frank G. Riddell: Shift reagents for 39K Nmr. In: Inorganica Chimica Acta. 92, 1984, S. L37–L39, doi:10.1016/S0020-1693(00)80044-4.