Cabozantinib
Cabozantinib ist ein Arzneistoff aus der Gruppe der Tyrosinkinase-Inhibitoren, der unter dem Handelsnamen Cabometyx zur Behandlung von Nierenkrebs und Leberkrebs sowie unter dem Handelsnamen Cometriq zur Behandlung von Schilddrüsenkrebs jeweils als Palliativtherapie eingesetzt wird, um das Überleben zu verlängern. Zur Behandlung von Nierenkrebs kann Cabozantinib mit Nivolumab kombiniert werden. Cabozantinib wird als Tablette oder Kapsel eingenommen. Es verlangsamt das Tumorwachstum, die Versorgung von Tumoren mit neuen Blutgefäßen (Neovaskularisation) und die Entstehung von Metastasen, indem es verschiedene an diesen Vorgängen beteiligte Rezeptor-Tyrosinkinasen hemmt. In der EU ist Cabozantinib seit 2014 (Cometriq) bzw. 2016 (Cabometyx) zugelassen. Inhaber der Zulassung in der EU ist Ipsen Pharma.[3][4][5][6] Entwickler des Wirkstoffs und Inhaber der Zulassung in den USA ist Exelixis.[7] In der Behandlung des medullärem Schilddrüsenkarzinoms gilt Cabozantinib in der EU als Orphan-Arzneimittel, d. h. als Arzneimittel gegen eine seltene Erkrankung.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
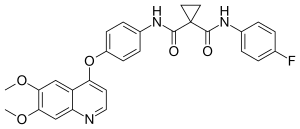
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Cabozantinib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C28H24FN3O5 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Inhibition verschiedener Rezeptor-Tyrosinkinasen, u. a. MET, VEGFR, RET, AXL (GAS6-Rezeptor), KIT und FLT3 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 501,51 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Klinische Angaben
BearbeitenAnwendungsgebiete
BearbeitenUnter dem Handelsnamen Cabometyx ist Cabozantinib zur Behandlung des Nierenzellkarzinoms (RCC) und des Leberzellkarzinoms (HCC) wie folgt indiziert:[3]
- Zur Behandlung erwachsener Patienten mit fortgeschrittenem Nierenzellkarzinom
- in Kombination mit Nivolumab zur Erstlinienbehandlung
- in Monotherapie zur Erstlinienbehandlung bei mittlerem oder hohem Risiko (gemäß Kriterien des International Metastatic RCC Database Consortium (IMDC)[8])
- in Monotherapie nach vorangegangener zielgerichteter Therapie gegen VEGF (vaskulärer endothelialer Wachstumsfaktor)
- Zur Behandlung erwachsener Patienten mit Leberzellkarzinom, die zuvor mit Sorafenib behandelt wurden
Unter dem Handelsnamen Cometriq ist Cabozantinib zur Behandlung des medullären Schilddrüsenkarzinoms wie folgt indiziert:[4]
- Zur Behandlung erwachsener Patienten mit progredienter, nicht resektabler, lokal fortgeschrittener oder metastasierter Erkrankung, wobei bei Patienten, deren RET-Mutationsstatus unbekannt oder negativ ist, vor der Entscheidung über die individuelle Behandlung ein möglicherweise geringerer Nutzen berücksichtigt werden sollte
Es handelt sich bei den zugelassenen Anwendungsgebieten jeweils um Stadien der Erkrankung, in denen eine Heilung nicht mehr möglich ist.
Zwar enthalten Cabometyx (Filmtabletten) und Cometriq (Kapseln) jeweils Cabozantinib als Wirkstoff, teils sogar in der gleichen Dosierung, jedoch sind sie nicht bioäquivalent und sollten nicht gegeneinander ausgetauscht werden. Es handelt sich um zwei verschiedene galenische Formen mit unterschiedlicher Pharmakokinetik: während Cabometyx Cabozantinib-L-malat enthält, ist in Cometriq Cabozantinib[(2S)-2-hydroxybutandioat] enthalten.[3][4]
Art und Dauer der Anwendung
BearbeitenCabozantinib wird in Form von Filmtabletten (Cabometyx) oder Kapseln (Cometriq) einmal täglich oral eingenommen, wobei die Dosierung von der jeweiligen Erkrankung und von der Art der Therapie (Mono- oder Kombinationstherapie) abhängt.
Die Behandlung soll so lange erfolgen, bis sie dem Patienten nicht mehr hilft oder bis nicht akzeptable Nebenwirkungen auftreten.[3][4]
Nebenwirkungen
BearbeitenCabozantinib hat oft schwere Nebenwirkungen. Die meisten Nebenwirkungen treten früh im Verlauf der Behandlung mit Cabozantinib auf. Daher sollte in den ersten acht Wochen der Behandlung eine engmaschige ärztliche Überwachung der Patienten erfolgen. Zu den Nebenwirkungen, die im Allgemeinen früh auftreten, gehören das Hand-Fuß-Syndrom und Nebenwirkungen im Magen-Darm-Trakt (Bauchschmerz, Schleimhautentzündung, Verstopfung, Durchfall und Erbrechen) sowie Bluthochdruck (Hypertonie) und Veränderungen verschiedener Laborparameter (Kalziummangel, Kaliummangel, Thrombozytopenie und Proteinurie).
Bei mehr als der Hälfte aller behandelten Patienten kam es in klinischen Studien zu Nebenwirkungen, die eine Dosisreduktion oder eine Unterbrechung der Behandlung erforderten. Oft waren zwei Dosisreduktionen erforderlich.
Manche schwerwiegenden Nebenwirkungen treten erst später im Verlauf der Behandlung mit Cabozantinib auf, darunter insbesondere Magen-Darm-Perforationen und Fisteln, die tödlich sein können und die bei etwa 3 % bzw. 1 % aller behandelten Patienten auftreten. In diesen Fällen muss die Behandlung mit Cabozantinib umgehend und dauerhaft angebrochen werden. Anhaltender bzw. wiederkehrender Durchfall während der Behandlung kann ein Risikofaktor für die Entstehung von Analfisteln sein.
Folgende Nebenwirkungen traten in klinischen Studien häufig (d. h. bei mindestens einem von hundert Patienten) in schwerwiegender Form auf:
- Bei der Behandlung von Nierenkrebs: Erschöpfung (Fatigue), Schwächegefühl (Asthenie), Schwindel, Appetitabnahme, Entwässerung, Unterleibsschmerzen, Durchfall, Übelkeit, Erbrechen, Bluthochdruck, Embolie, Lungenembolie, tiefe Venenthrombose, Magnesiummangel, Natriummangel und Hand-Fuß-Syndrom.
- Bei der Behandlung von Leberkrebs: Erschöpfung, Schwächegefühl, Unterleibsschmerzen, Durchfall, Erbrechen, hepatische Enzephalopathie, Thrombozytopenie, Natriummangel und Hand-Fuß-Syndrom.
- Bei der Behandlung von Schilddrüsenkrebs: Lungenentzündung, Schleimhautentzündung, Kalziummangel, Schluckstörung (Dysphagie), Entwässerung und Lungenembolie
Weitere mögliche Nebenwirkungen von Cabozantinib sind Blutungen, Aneurysmen, Störungen des Herzrhythmus, Nekrosen des Kieferknochens, Posteriores reversibles Enzephalopathie-Syndrom und eine Funktionsstörung der Schilddrüse.
Cabozantinib schädigt die Leber. Abnorme Leberwerte wurden häufig bei mit Cabozantinib behandelten Patienten beobachtet. Die Leberwerte (ALT, AST und Bilirubin) sollten während der Behandlung überwacht werden.[3][4]
Wechselwirkungen mit anderen Medikamenten
BearbeitenCabozantinib ist ein Substrat von Cytochrom P450 3A4 (CYP3A4). Vorsicht ist geboten bei der Anwendung von Cabozantinib mit starken CYP3A4-Inhibitoren wie Ketoconazol. Die Langzeitanwendung von starken CYP3A4-Induktoren wie Rifampicin gleichzeitig mit Cabozantinib sollte vermieden werden.
Cabozantinib ist ein Inhibitor des P-Glykoproteins (P-gp), was die Wirkung von P-gp-Substraten während der gleichzeitigen Einnahme von Cabozantinib beeinflussen kann. Zu diesen gehören u. a. Aliskiren, Dabigatran, Digoxin, Saxagliptin und Sitagliptin.
Ebenso kann es bei Anwendung von MRP2-Inhibitoren wie z. B. Cyclosporin, Efavirenz oder Emtricitabin gleichzeitig mit Cabozantinib zu Wechselwirkungen kommen.[3][4]
Anwendung während Schwangerschaft und Stillzeit
BearbeitenCabozantinib darf während einer Schwangerschaft nicht angewendet werden, außer wenn dies klinisch unbedingt erforderlich ist, da es embryotoxisch und teratogen wirkt. Wegen der potenziellen Gefahr für den Säugling sollten Mütter während der Behandlung mit Cabozantinib und für die Dauer von mindestens 4 Monate nach Abschluss der Therapie nicht stillen.
Eine Beeinträchtigung der Fruchtbarkeit von Mann und Frau durch die Behandlung mit Cabozantinib ist wahrscheinlich. Sowohl Männern als auch Frauen sollte eine entsprechende Beratung empfohlen werden. Rechtzeitig vor Beginn der Behandlung sind Maßnahmen zur Erhaltung der Fruchtbarkeit in Erwägung zu ziehen.[3][4]
Besondere Patientengruppen
BearbeitenBei Patienten mit leicht oder mittelschwer eingeschränkter Nierenfunktion sollte Cabozantinib mit Vorsicht angewendet werden. Bei Patienten mit schwer eingeschränkter Nierenfunktion wird Cabozantinib nicht empfohlen.
Bei Patienten mit mittelschwer eingeschränkter Leberfunktion wird eine engmaschige Überwachung empfohlen. Bei Patienten mit schwerer Leberfunktionsstörung wird Cabozantinib nicht empfohlen.
Bei Patienten mit einem Risiko für Thromboembolien oder mit entsprechenden Ereignissen in der Vorgeschichte sollte Cabozantinib mit Vorsicht angewendet werden.
Bei Patienten mit schweren Blutungen oder mit einem Risiko dafür soll Cabozantinib nicht angewendet werden.[3][4]
Pharmakologische Eigenschaften
BearbeitenWirkungsmechanismus
BearbeitenCabozantinib ist ein Tyrosinkinase-Inhibitor, der verschiedene Rezeptor-Tyrosinkinasen (RTK) hemmt. Dazu gehören insbesondere der für die Angiogenese wichtige VEGF(vaskulärer endothelialer Wachstumsfaktor)-Rezeptor (VEGFR) und der Hepatozyten-Wachstumsfaktor-Rezeptor (MET) mit mittleren inhibitorischen Konzentrationen (IC50) von 0,035 und 1,3 nᴍ,[9] jedoch auch weitere RTK, darunter RET, AXL (GAS6-Rezeptor), KIT und FLT3. Bestimmte RTK sind an Tumorwachstum, Angiogenese, pathologischem Knochenumbau, Arzneimittelresistenz und Entwicklung von Metastasen beteiligt. Durch Hemmung der RTK verlangsamt Cabozantinib diese Vorgänge.[3][4]
In Krebszellen sind RTK oft dysreguliert und/oder überexprimiert. Bei der Entstehung des konventionellen (klarzelligen) Nierenzellkarzinoms ist ein Funktionsverlust des Tumorsuppressors Von-Hippel-Lindau (VHL) ein charakteristisches frühes Ereignis, das eine Überexpression von VEGF sowie der RTK MET und AXL zur Folge hat.[10][9]
Aufnahme und Verteilung im Körper
BearbeitenDer maximale Plasmaspiegel (Cmax) wird innerhalb von 3–4 Stunden nach der Einnahme erreicht. Ein zweiter Resorptionsgipfel tritt ungefähr 24 Stunden nach der Einnahme auf, was darauf schließen lässt, dass Cabozantinib möglicherweise einem enterohepatischen Kreislauf unterliegt.
Der Verzehr einer sehr fetthaltigen Mahlzeit führte bei gesunden Probanden zu einem moderaten Anstieg der Cmax und der AUC-Werte (41 % bzw. 57 %) im Vergleich zum nüchternen Zustand.
Die terminale Plasmahalbwertszeit von Cabozantinib nach oraler Gabe liegt bei etwa 110 Stunden, also bei etwa 4–5 Tagen.
Frühe Nutzenbewertung
BearbeitenIn Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Nierenzellkarzinom
BearbeitenNach VEGF-Vortherapie, Monotherapie (2017)
BearbeitenDie erste frühe Nutzenbewertung von Cabozantinib erfolgte 2017 für die Behandlung des fortgeschrittenen Nierenzellkarzinoms in Monotherapie nach vorangegangener zielgerichteter Therapie gegen VEGF. Der Vergleich konnte gegenüber Everolimus oder Nivolumab erfolgen und erfolgte gegenüber Everolimus. Einerseits verlängerte sich das Gesamtüberleben bei Behandlung mit Cabozantinib (21,4 gegenüber 17,1 Monaten in der maßgeblichen Studie METEOR), andererseits traten auch mehr schwere Nebenwirkungen auf. Der G-BA stellte daher einen Hinweis auf einen geringen Zusatznutzen fest.[11]
Erstlinie, Monotherapie (2018)
BearbeitenIm Jahr 2018 erfolgte die frühe Nutzenbewertung von Cabozantinib in Monotherapie für die Erstlinientherapie des fortgeschrittenen Nierenzellkarzinoms. Abhängig davon, ob ein mittleres oder hohes Risiko gemäß IMDC-Kriterien[8] bestand, erfolgte der Vergleich gegenüber Sunitinib oder Temsirolimus, wobei zum Vergleich mit Temsirolimus keine Daten vorlagen. Bei Patienten mit mittlerem Risiko verlängerte sich im Vergleich zu Sunitinib das Gesamtüberleben, allerdings ausschließlich bei Patienten mit hoher Expression des Hepatozyten-Wachstumsfaktor-Rezeptors (MET). Ebenso traten mehr schwere Nebenwirkungen auf, allerdings ausschließlich bei Frauen. Eine sinnvolle Interpretation der Ergebnisse war daher nicht möglich. Darüber hinaus lagen keine Daten zu Lebensqualität der Patienten vor, der jedoch aufgrund der palliativen Therapiesituation durch den G-BA ein hoher Stellenwert beigemessen wurde. Aus diesen und weiteren Gründen ist daher gemäß G-BA-Beschluss für Cabozantinib in Monotherapie als Erstlinienbehandlung des fortgeschrittenen Nierenzellkarzinoms ein Zusatznutzen gegenüber der Vergleichstherapie nicht belegt.[12]
Erstlinie, Kombination mit Nivolumab (2021)
BearbeitenIm Jahr 2021 erfolgte die frühe Nutzenbewertung von Cabozantinib in Kombination mit Nivolumab für die Erstlinientherapie des fortgeschrittenen Nierenzellkarzinoms. Der Vergleich erfolgte gegenüber Pembrolizumab in Kombination mit Axitinib, wobei für Patienten mit mittlerem oder hohem Risiko gemäß IMDC-Kriterien[8] (d. h. mit IMDC-Score 1 oder höher) gemäß G-BA auch andere Vergleichstherapien grundsätzlich infrage kamen. Da es keine klinischen Studien zum direkten Vergleich von Cabozantinib + Nivolumab gegenüber Pembrolizumab + Axitinib gab, erfolgte der Vergleich indirekt über Sunitinib als Brückenkomparator anhand der Studien CheckMate 9ER (Cabozantinib + Nivolumab vs. Sunitinib)[13] und KEYNOTE-426 (Pembrolizumab + Axitinib vs. Sunitinib).[14] Hierbei waren ausschließlich die Ergebnisse zum Gesamtüberleben für Patienten mit mittlerem oder hohem Risiko verwertbar, die jedoch keinen Unterschied zwischen den Behandlungen zeigten. Gemäß G-BA-Beschluss gilt daher für Cabozantinib in Kombination mit Nivolumab als Erstlinienbehandlung des fortgeschrittenen Nierenzellkarzinoms ein Zusatznutzen gegenüber der Vergleichstherapie als nicht belegt.[15]
Leberzellkarzinom (2019)
BearbeitenIm Jahr 2019 erfolgte die frühe Nutzenbewertung von Cabozantinib für die Therapie des unheilbaren Leberzellkarzinoms bei Patienten, die zuvor mit Sorafenib behandelt worden waren. Der Vergleich erfolgte gegenüber einer bestmöglichen unterstützenden Behandlung (Best Supportive Care, BSC), also einer Behandlung, die nicht direkt gegen die Erkrankung gerichtet ist, sondern die nur der Linderung von Symptomen und Verbesserung der Lebensqualität dient. Grundlage der Bewertung war die Studie CELESTIAL[16], die auch als Schlüsselstudie für die Zulassung in dieser Indikation diente. Es wurde eine Verlängerung des Gesamtüberlebens um zwei Monate festgestellt (10,3 gegenüber 8,2 Monaten), jedoch auch erheblich mehr schwere Nebenwirkungen. Zur Lebensqualität lagen keine Daten vor. Gemäß G-BA-Beschluss besteht daher für Cabozantinib gegenüber BSC ein Anhaltspunkt für einen geringen Zusatznutzen.[17]
Die aktuelle deutsche S3-Leitlinie zur Diagnostik und Therapie des hepatozellulären Karzinoms nennt Cabozantinib als eine von mehreren möglichen Therapieoptionen bei Patienten mit einem unheilbaren Leberzellkarzinom, das nach vorheriger Behandlung mit Sorafenib progredient war. Gemäß Leitlinien soll diesen Patienten bei erhaltener Leberfunktion (Child-Pugh-Stadium A) und gutem Allgemeinzustand (ECOG-Status 0–1) eine Therapie mit Cabozantinib, Regorafenib oder in bestimmten Fällen Ramucirumab angeboten werden.[18]
Schilddrüsenkarzinom (2021)
BearbeitenDie erste frühe Nutzenbewertung von Cabozantinib für die Therapie des unheilbaren medullären Schilddrüsenkarzinoms erfolgte 2015. Der damalige, mittlerweile aufgehobene Beschluss zum Zusatznutzen war zeitlich befristet, da für Cabozantinib in dieser Indikation nur eine bedingte Zulassung vorlag.[19] Nach Ablauf der Befristung im Jahr 2021 erfolgte eine erneute Bewertung. Hierbei wurden die Ergebnisse der Studie EXAM (XL184-301)[20] betrachtet. Dabei wurden keine Unterschiede in Bezug auf die Gesamtmortalität festgestellt, jedoch deutlich mehr schwere Nebenwirkungen. Zur Lebensqualität lagen keine Daten vor. Da jedoch Cabozantinib in dieser Indikation ein Orphan-Arzneimittel ist, und da der Zusatznutzen von Orphan-Arzneimitteln durch deren Zulassung formell als belegt gilt (gemäß § 35a Abs 1, S. 10 SGB V), liegt gemäß G-BA-Beschluss ein Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen vor.[21]
Studien
BearbeitenZu Cabozantinib wurde eine Vielzahl klinischer Studien durchgeführt. Im Folgenden werden die Schlüsselstudien beschrieben, die zur Zulassung von Cabozantinib führten.
Nierenzellkarzinom
BearbeitenNach VEGFR-Vortherapie, Monotherapie (METEOR)
BearbeitenDie Studie METEOR (XL184-308) verglich Cabozantinib mit Everolimus jeweils in Monotherapie bei Patienten mit einem metastasierten Nierenzellkarzinom, das nach vorheriger Behandlung mit einem anderen gegen VEGFR gerichteten Tyrosinkinase-Inhibitor progredient war. Es handelte sich um eine multizentrische, randomisierte, offene, aktiv kontrollierte Phase-III-Studie, an der insgesamt 658 Patienten teilnahmen. Primärer Endpunkt war das progressionsfreie Überleben (engl. progression-free survival, PFS).[22]
In der primären Analyse der Studie zeigte sich bei Behandlung mit Cabozantinib gegenüber Everolimus eine signifikante Verlängerung des medianen PFS um 3,6 Monate, was etwa einer Verdopplung entspricht.[23] In der finalen Analyse wurde auch für das Gesamtüberleben unter Cabozantinib eine signifikante Verlängerung festgestellt (21,4 gegenüber 16,5 Monaten), wobei auch deutlich mehr Nebenwirkungen auftraten.[24]
Erstlinie, Monotherapie (CABOSUN)
BearbeitenDie Studie CABOSUN (A031203) verglich Cabozantinib mit Sunitinib jeweils in Monotherapie bei Patienten mit einem lokal fortgeschrittenem oder metastasiertem Nierenzellkarzinom mittleren oder hohen Risikos (gemäß IMDC-Kriterien[8]), die bislang nicht mit einer systemischen Therapie für diese Erkrankung behandelt worden waren (Erstlinientherapie). Es handelte sich um eine multizentrische, randomisierte, offene, aktiv kontrollierte Phase-II-Studie, an der insgesamt 157 Patienten teilnahmen. Primärer Endpunkt war das PFS.[25]
In der finalen Analyse des medianen PFS zeigte sich bei Behandlung mit Cabozantinib gegenüber Sunitinib eine signifikante Verlängerung (8,6 gegenüber 5,3 Monaten).[26] In der finalen Analyse des medianen Gesamtüberlebens zeigte sich zwar numerisch eine deutliche Verlängerung (30,3 gegenüber 21,0 Monaten), die aufgrund starker Schwankungen der Einzelergebnisse jedoch nicht signifikant war.[27] Schwerwiegende Nebenwirkungen traten unter Cabozantinib und Sunitinib etwa gleich häufig auf.[26]
CABOSUN war ursprünglich nicht als Schlüsselstudie zur Erweiterung der Zulassung von Cabozantinib geplant. Sponsor der Studie war kein pharmazeutisches Unternehmen, sondern die Alliance for Clinical Trials in Oncology, ein Forschungsnetzwerk des staatlichen National Cancer Institute in den USA. Nachdem die Ergebnisse vorlagen, reichte das Unternehmen Exelixis diese bei der FDA und später auch bei der europäische Zulassungsbehörde EMA ein, um eine Zulassungserweiterung für Cabozantinib zu beantragen.[27][28]
Erstlinie, Kombination mit Nivolumab (CheckMate 9ER)
BearbeitenDie Studie CheckMate 9ER (CA2099ER) verglich Cabozantinib in Kombination mit Nivolumab mit Sunitinib bei Patienten mit fortgeschrittenem oder metastasiertem Nierenzellkarzinom, die in diesem Krankheitsstadium noch keine vorherige Therapie erhalten hatten (Erstlinientherapie). Es handelte sich um eine multizentrische, randomisierte, offene, aktiv kontrollierte Phase-III-Studie, an der insgesamt 651 Patienten teilnahmen. Primärer Endpunkt war das PFS.[13]
In der finalen Analyse des medianen PFS zeigte sich bei Behandlung mit Cabozantinib gegenüber Sunitinib eine signifikante Verlängerung (16,6 gegenüber 8,3 Monaten).[29] Auch für das mediane Gesamtüberlebens wurde in der finalen Analyse eine signifikante Verlängerung festgestellt (37,7 gegenüber 34,3 Monaten), wobei auch deutlich mehr schwere Nebenwirkungen auftraten (bei 65,0 % gegenüber 54,1 % der Patienten).[30]
Leberzellkarzinom (CELESTIAL)
BearbeitenDie Studie CELESTIAL (XL184-309) verglich Cabozantinib mit Placebo bei Patienten mit unheilbarem Leberzellkarzinom, das nach vorheriger Behandlung mit Sorafenib progredient war. Es handelte sich um eine multizentrische, 2:1-randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie, an der insgesamt 707 Patienten teilnahmen. Primärer Endpunkt war das Gesamtüberleben.[16]
In der zweiten geplanten Interimsanalyse der Studie zeigte sich bei Behandlung mit Cabozantinib gegenüber Placebo eine signifikante Verlängerung des Gesamtüberlebens (10,2 gegenüber 8,0 Monaten). Schwere Nebenwirkungen (im Sinne unerwünschter Ereignisse im zeitlichen Zusammenhang mit der Behandlung) traten bei Behandlung mit Cabozantinib deutlich häufiger auf (bei 68 % gegenüber 36 % der Patienten).[31]
Schilddrüsenkarzinom (EXAM und EXAMINER)
BearbeitenDie Studie EXAM (XL184-301) verglich Cabozantinib in einer Dosis von 140 mg/Tag mit Placebo bei Patienten mit unheilbarem, progredientem medullärem Schilddrüsenkarzinom. Es handelte sich um eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie, an der insgesamt 330 Patienten teilnahmen. Primärer Endpunkt war das PFS.[20]
In der primären Analyse des medianen PFS zeigte sich bei Behandlung mit Cabozantinib gegenüber Sunitinib eine signifikante Verlängerung (11,2 gegenüber 4,0 Monaten), jedoch kam es auch zu deutlich mehr Behandlungsunterbrechungen und -abbrüchen aufgrund von Nebenwirkungen.[32] Die finale Analyse des medianen Gesamtüberlebens zeigte eine numerische Verlängerung (26,6 gegenüber 21,1 Monaten), die jedoch nicht signifikant war. Eine explorative Datenanalyse der Daten zeigte für Patienten mit einer bestimmten Mutation des RET-Gens (RET-M918T) eine signifikante Verlängerung des Gesamtüberlebens.[33]
Aufgrund der in der Studie EXAM beobachteten hohen Rate an Nebenwirkungen und Dosisanpassungen hatte die EMA ursprünglich zunächst eine bedingte Zulassung erteilt und als Auflage eine weitere Studie gefordert, in der die Wirksamkeit und Sicherheit verschiedener Dosierungen von Cabozantinib weiter untersucht werden.[6] Dieser Auflage wurde in Form der Studie EXAMINER (XL184-401) nachgekommen. Diese untersuchte, ob Cabozantinib in einer Dosis von 60 mg/Tag bei vergleichbarer Wirksamkeit weniger Nebenwirkungen verursacht als in der Dosis von 140 mg/Tag. Es handelte sich um eine multizentrische, randomisierte, doppelblinde Phase-IV-Studie, an der insgesamt 247 Patienten teilnahmen. Primärer Endpunkt war das PFS.[34] Der primäre Endpunkt der Studie wurde jedoch nicht erreicht und die Nichtunterlegenheit der Dosis von 60 mg/Tag konnte daher nicht nachgewiesen werden.[35] Die zugelassene Dosierung zur Behandlung des medullären Schilddrüsenkarzinoms ist weiterhin eine Dosis von 140 mg/Tag.[4]
Einzelnachweise
Bearbeiten- ↑ MSDS XL184. (PDF; 0,2 MB) caymanchem; abgerufen am 26. Mai 2022.
- ↑ Datenblatt Cabozantinib bei Sigma-Aldrich, abgerufen am 4. September 2024 (PDF).
- ↑ a b c d e f g h i Cabometyx: Zusammenfassung der Merkmale des Arzneimittels (Fachinformation). (PDF) Europäische Arzneimittel-Agentur (EMA), 1. Dezember 2021, abgerufen am 24. März 2022.
- ↑ a b c d e f g h i j Cometriq: Zusammenfassung der Merkmale des Arzneimittels (Fachinformation). (PDF) Europäische Arzneimittel-Agentur (EMA), 6. Oktober 2021, abgerufen am 24. März 2022.
- ↑ Cabometyx: European Public Assessment Report (EPAR). Europäische Arzneimittel-Agentur (EMA), 1. Dezember 2021, abgerufen am 24. März 2022.
- ↑ a b c Cometriq: European Public Assessment Report (EPAR). Europäische Arzneimittel-Agentur (EMA), 6. Oktober 2021, abgerufen am 24. März 2022.
- ↑ Drugs@FDA: Cometriq. Food and Drug Administration (FDA), Oktober 2020, abgerufen am 23. Mai 2022.
- ↑ a b c d IMDC Risk Calculator. International Metastatic RCC Database Consortium (IMDC), Juli 2021, abgerufen am 25. März 2022.
- ↑ a b Nityam Rathi, Benjamin L. Maughan, Neeraj Agarwal, Umang Swami: Mini-Review: Cabozantinib in the Treatment of Advanced Renal Cell Carcinoma and Hepatocellular Carcinoma. In: Cancer Manag Res. Band 12, 2020, S. 3741–3749, doi:10.2147/CMAR.S202973, PMID 32547210, PMC 7246323 (freier Volltext).
- ↑ Toni K Choueiri, William G Kaelin Jr: Targeting the HIF2-VEGF axis in renal cell carcinoma. In: Nature Medicine. Band 26, Nr. 10, Oktober 2020, S. 1519–1530, doi:10.1038/s41591-020-1093-z, PMID 33020645.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (Neubewertung nach Fristablauf: Nierenzellkarzinom, nach VEGF-Vortherapie). Gemeinsamer Bundesausschuss (G-BA), 5. April 2018, abgerufen am 13. Mai 2022.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (neues Anwendungsgebiet: Nierenzellkarzinom, Erstlinie). Gemeinsamer Bundesausschuss (G-BA), 6. Dezember 2018, abgerufen am 13. Mai 2022.
- ↑ a b NCT03141177 A Study of Nivolumab Combined With Cabozantinib Compared to Sunitinib in Previously Untreated Advanced or Metastatic Renal Cell Carcinoma (CheckMate 9ER) ClinicalTrials.gov
- ↑ NCT02853331 Study to Evaluate the Efficacy and Safety of Pembrolizumab (MK-3475) in Combination With Axitinib Versus Sunitinib Monotherapy in Participants With Renal Cell Carcinoma (MK-3475-426/KEYNOTE-426) ClinicalTrials.gov
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (Neues Anwendungsgebiet: Nierenzellkarzinom, Erstlinienbehandlung, Kombination mit Nivolumab). Gemeinsamer Bundesausschuss (G-BA), 21. Oktober 2021, abgerufen am 16. Mai 2022.
- ↑ a b NCT01908426 Study of Cabozantinib (XL184) vs Placebo in Subjects With Hepatocellular Carcinoma Who Have Received Prior Sorafenib (CELESTIAL) ClinicalTrials.gov
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (neues Anwendungsgebiet: Hepatozelluläres Karzinom). Gemeinsamer Bundesausschuss (G-BA), 6. Juni 2019, abgerufen am 19. Mai 2022.
- ↑ AWMF, DKG und DKH (Hrsg.): S3-Leitlinie Diagnostik und Therapie des Hepatozellulären Karzinoms und biliärer Karzinome, Langversion 3.0, AWMF-Registernummer: 032/053OL. Juli 2022, S. 87 (leitlinienprogramm-onkologie.de [abgerufen am 9. September 2022]).
- ↑ Gemeinsamer Bundesausschuss (G-BA): Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (Schilddrüsenkarzinom). 22. Januar 2015, abgerufen am 23. Mai 2022.
- ↑ a b NCT00704730 Efficacy of XL184 (Cabozantinib) in Advanced Medullary Thyroid Cancer (EXAM) ClinicalTrials.gov
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Cabozantinib (Neubewertung nach Fristablauf: Schilddrüsenkarzinom). Gemeinsamer Bundesausschuss (G-BA), 16. Dezember 2021, abgerufen am 23. Mai 2022.
- ↑ NCT01865747 A Study of Cabozantinib (XL184) vs Everolimus in Subjects With Metastatic Renal Cell Carcinoma (METEOR) ClinicalTrials.gov
- ↑ T. K. Choueiri, B. Escudier, T. Powles u. a.: Cabozantinib versus Everolimus in Advanced Renal-Cell Carcinoma. In: N Engl J Med. Band 373, 5. November 2015, S. 1814–1823, doi:10.1056/NEJMoa1510016, PMID 26406150, PMC 5024539 (freier Volltext).
- ↑ T. K. Choueiri, B. Escudier, T. Powles u. a.: Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial. In: Lancet Oncol. Band 17, Nr. 7, Juli 2016, S. 917–927, doi:10.1016/S1470-2045(16)30107-3, PMID 27279544.
- ↑ NCT01835158 Cabozantinib-s-malate or Sunitinib Malate in Treating Patients With Previously Untreated Locally Advanced or Metastatic Kidney Cancer ClinicalTrials.gov
- ↑ a b T. K. Choueiri, S. Halabi, B. L. Sanford u. a.: Cabozantinib Versus Sunitinib As Initial Targeted Therapy for Patients With Metastatic Renal Cell Carcinoma of Poor or Intermediate Risk: The Alliance A031203 CABOSUN Trial. In: J Clin Oncol. Band 35, Nr. 6, 14. November 2017, S. 591–597, doi:10.1200/JCO.2016.70.7398, PMID 28199818, PMC 5455807 (freier Volltext).
- ↑ a b Cabometyx-H-C-004163-II-0003 : EPAR - Assessment report - Variation; EMA/235286/2018. (PDF; 4 MB) Europäische Arzneimittel-Agentur (EMA), 7. Juni 2018, abgerufen am 28. März 2022.
- ↑ A18-37 Cabozantinib (Nierenzellkarzinom) – Nutzenbewertung gemäß § 35a SGB V. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), 13. September 2018, abgerufen am 13. Mai 2022.
- ↑ T. K. Choueiri, T. Powles, M. Burotto u. a.: Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. In: N Engl J Med. Band 384, Nr. 9, 4. März 2021, S. 829–841, doi:10.1056/NEJMoa2026982, PMID 33657295, PMC 8436591 (freier Volltext).
- ↑ T. Powles, T. K. Choueiri, M. Burotto u. a.: Final overall survival analysis and organ-specific target lesion assessments with two-year follow-up in CheckMate 9ER: Nivolumab plus cabozantinib versus sunitinib for patients with advanced renal cell carcinoma. In: J Clin Oncol. 6_suppl, 20. Februar 2022, S. 350, doi:10.1200/JCO.2022.40.6_suppl.350.
- ↑ G. K. Abou-Alfa, T. Meyer, A. L. Cheng u. a.: Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. In: N Engl J Med. Band 379, Nr. 1, 5. Juli 2018, S. 54–63, doi:10.1056/NEJMoa1717002, PMID 29972759, PMC 7523244 (freier Volltext).
- ↑ R. Elisei, M. J. Schlumberger, S. P. Müller u. a.: Cabozantinib in Progressive Medullary Thyroid Cancer. In: J Clin Oncol. Band 31, Nr. 29, 10. Oktober 2013, S. 3639–3646, doi:10.1200/JCO.2012.48.4659, PMID 24002501, PMC 4164813 (freier Volltext).
- ↑ M. Schlumberger, R. Elisei, S. Müller u. a.: Overall survival analysis of EXAM, a phase III trial of cabozantinib in patients with radiographically progressive medullary thyroid carcinoma. In: Ann Oncol. Band 28, Nr. 11, 1. November 2017, S. 2813–2819, doi:10.1093/annonc/mdx479, PMID 29045520, PMC 5834040 (freier Volltext).
- ↑ NCT01896479 A Study of Two Different Doses of Cabozantinib (XL184) in Progressive, Metastatic Medullary Thyroid Cancer (EXAMINER) ClinicalTrials.gov
- ↑ J. Capdevila, A. Klochikhin, S. Leboulleux: A Randomized, Double-Blind Noninferiority Study to Evaluate the Efficacy of the Cabozantinib Tablet at 60 mg Per Day Compared with the Cabozantinib Capsule at 140 mg Per Day in Patients with Progressive, Metastatic Medullary Thyroid Cancer. In: Thyroid. Band 32, Nr. 5, 1. Mai 2022, S. 515–524, doi:10.1089/thy.2022.0027, PMID 35403447.