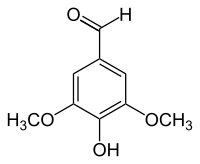
Syringaldehyd, seltener auch Syringaaldehyd[2] (3,5-Dimethoxy-4-hydroxybenzaldehyd, FEMA 4049[1]) ist eine organisch-chemische Verbindung mit der Summenformel C9H10O4. Es ist ein Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und zwei Methoxygruppen als Substituenten. Der Name des Aldehyds stammt von der lateinischen Bezeichnung des Flieders (Syringa).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Syringaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H10O4 | ||||||||||||||||||
| Kurzbeschreibung |
Blassgelbe Nadeln[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
2,59·10−4 Pa (25 °C)[3] | ||||||||||||||||||
| pKS-Wert |
7,0 ± 0,2[4] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Geschichte und Vorkommen
BearbeitenDer Aldehyd wurde erstmals 1889 aus dem im Flieder Syringa vulgaris vorkommenden Glucosid Syringin durch Oxidation und Hydrolyse gewonnen.[2] Syringaldehyd kommt natürlich auch in Ananas,[6] der Kokospalme,[7] Echtem Koriander,[7] Walnüssen,[7] Tomaten,[7] Mais,[7] Roteichen,[7] Sägepalmen,[7] Gewürzvanille,[7] Weinreben,[7] Bier,[6] Weinbrand,[6] Rum, vielen verschiedenen Whisky-Sorten,[6] Sherry,[6] gerösteter Gerste[6] und Hartholzrauch[6] vor.
-
Gemeiner Flieder
-
Strukturformel von Syringin
(β-D-Glucosid des Sinapylalkohols)
Gewinnung und Darstellung
BearbeitenNatürliche Quellen
BearbeitenSyringaldehyd entsteht – oft neben erheblichen Mengen Vanillin – beim oxidativen Abbau von Lignin[8][9][10], allerdings mit stark schwankenden Ausbeuten, die entscheidend von der verwendeten Biomasse und den Reaktionsbedingungen abhängen.
Chemische Synthesen
BearbeitenAuf chemischem Wege kann Syringaldehyd durch Reaktion von Vanillin mit Iod zum 5-Iodvanillin und nucleophiler Substitution des Iods durch eine Methoxygruppe in Gegenwart eines Kupfer-Katalysators dargestellt werden.[11] Wesentlich wirtschaftlicher ist der Weg über 5-Bromvanillin, das aus Vanillin entweder durch vollständige Bromierung in Gegenwart eines Imids in zweiphasigem wässrig organischem Lösungsmittelgemisch und Rückoxidation von HBr mit Chlor[12] oder homogen in 95%iger Ausbeute[13] in Methanol erhältlich ist. Brom-Methanol-Gemische sind allerdings selbst reaktiv.[14]
Der Austausch des Bromatoms gegen eine Methoxygruppe gelingt durch Elektronentransferkatalyse durch Kupfersalze unter vergleichsweise milden Reaktionsbedingungen (3 Stunden bei 125 °C) in Methanol/Natriummethanolat im Autoklaven unter Katalyse mit einem System aus basischem Kupfercarbonat und Kohlendioxid in 99%iger Ausbeute.[15] oder in Dimethylformamid mit Natriummethanolat mit Kupfer(I)-chlorid in einer Gesamtausbeute von 86 % bezüglich Vanillin.[13] Einfachere, drucklose Reaktionsführung der Übergangsmetall-induzierten nucleophilen Substitution erlaubt erst der Einsatz von Kupfer(I)komplexen in DMF.[12]
Alternativ ist Syringaldehyd durch regioselektive Demethylierung von 3,4,5-Trimethoxybenzaldehyd im Sauren mit Schwefelsäure[16] in 96%iger Ausbeute, mit Aluminiumchlorid[17] in 95%iger Ausbeute und im Basischen mit wässrigem Dimethylamin unter Druck in 72%iger Ausbeute[18] zugänglich.
Ebenfalls möglich ist die Synthese durch die Duff-Reaktion.[19]
Ausgehend von dem industriell verfügbaren p-Kresol wird Syringaldehyd in einer dreistufigen Synthese über 2,6-Dibrom-4-methylphenol (96,5 % Ausbeute), 2,6-Dimethoxy-4-methylphenol (84 %) und Oxidation der Methylgruppe (91 %) in einer Gesamtausbeute von 63 bis 67 % erhalten.[20]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenSyringaldehyd ist ein in blassgelben Nadeln kristallisierender[2] Feststoff, der nahezu unlöslich in Wasser ist[5][6] sich aber in Ethanol, Diethylether und Eisessig löst.[2] Es schmilzt bei 110–113 °C[6] und siedet bei 192–193 °C bei Unterdruck (19 hPa).[2]
Chemische Eigenschaften
BearbeitenDie Substanz leitet sich strukturell sowohl vom Benzaldehyd als auch vom Syringol (2,6-Dimethoxyphenol) ab. Infolge seines bifunktionalen Charakters ist Syringaldehyd sehr reaktionsfreudig. Durch Veretherung, Veresterung oder Aldolkondensation sind sehr viele Derivate synthetisierbar.
Der pKs-Wert der phenolischen OH-Gruppe des Syringaldehyds beträgt 7,0 ± 0,2.[4] Dieser Wert ist gegenüber dem Syringol mit 9,98[21] deutlich niedriger. Die elektronenziehende Aldehydgruppe erhöht durch ihren −M-Effekt die OH-Acidität; die phenolische OH-Bindung wird zunehmend polarisiert. Ähnlich verhält es sich im Vergleich von 4-Hydroxybenzaldehyd mit einem pKs-Wert von 7,66[22] zu Phenol mit 9,99[22], sowie von Vanillin mit einem pKs-Wert von 7,40[22] zu Guajacol (2-Methoxyphenol) mit 9,98.[22]
Strukturelle und namentliche Verwandte
Bearbeiten| Syringol | Syringaalkohol | Syringaldehyd | Syringasäure | Acetosyringon |
Verwendung
BearbeitenDer Aldehyd wird als Zwischenprodukt in chemischen Synthesen und als Duftstoff in der Parfümerie eingesetzt.[2]
Syringaldehyd findet wegen seiner vielfältigen Bioaktivitäten ebenso wie wegen seiner Brauchbarkeit als Molekülbaustein für diverse Wirkstoffsynthesen zunehmendes Interesse.[23] Als natürliches Antioxidans hemmt Syringaldehyd wirksam die Oxidation von ungesättigten Ölen und Lecithinen.[24]
Syringaldehyd wirkt zudem hemmend auf das Wachstum der Xylit-produzierenden Hefe Candida guilliermondii.[25] Die bisher bestimmten antimikrobiellen und enzymhemmenden Wirksamkeiten von Syringaldehyd sind gegenüber Standardvergleichssubstanzen relativ schwach.[23] Da Syringaldehyd auch bei der Pyrolyse von Lignin, z. B. beim Verbrennen von Hartholz entsteht, kann Syringaldehyd als molekularer Marker für Rauchemissionen in die Atmosphäre verwendet werden.[26][27]
Syringaldehyd ist ein Ausgangsstoff für 3,4,5-Trimethoxybenzaldehyd[12], einer Schlüsselverbindung zur Synthese des Antibiotikums Trimethoprim. Nach einer neueren Vorschrift[28] wird die Zielverbindung aus p-Kresol über das Natriumsalz des Syringaldehyds in einer Gesamtausbeute von 67,4 % erhalten.
Die Knoevenagel-Reaktion von Syringaldehyd mit Bis(2-ethylhexyl)malonat (durch Umesterung von Malonsäurediethylester mit 2-Ethylhexanol) in Gegenwart von Piperidin-Essigsäure liefert in 91%iger Ausbeute Bis(2-ethylhexyl)-3,5-dimethoxy-4-hydroxy-benzylidenmalonat (DESM, Oxynex ST).[29]
Es wird als Photostabilisator und Antioxidans in kosmetischen Zubereitungen verwendet, insbesondere zur Stabilisierung von UV-Filtern, wie z. B. Avobenzon in Sonnenschutzmitteln.[30]
Die katalytische Hydrierung der Benzylidenfunktion führt zu Bis(2-ethylhexyl)-3,5-dimethoxy-4-hydroxy-benzylmalonat (HDBM, Ronacare AP)[31], das die durch UV-, VIS- und Nahinfrarot-Licht ausgelöste Bildung reaktiver Sauerstoffradikale (ROS) wirksam unterdrückt und daher Anwendung in Kosmetika mit Lichtschutzfunktion findet.[32]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b Eintrag zu FEMA 4049 in der Datenbank der Flavor and Extract Manufacturers Association of the United States.
- ↑ a b c d e f g h i j k Eintrag zu Syringaaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. März 2017.
- ↑ Ana R.R.P. Almeida; Bruno D.A. Pinheiro; Ana I.M.C. Lobo Ferreira; Manuel J.S. Monte: Study on the volatility of four benzaldehydes in Thermochim. Acta 717 (2022) 179357, doi:10.1016/j.tca.2022.179357.
- ↑ a b Feng Xu: Effects of Redox Potential and Hydroxide Inhibition on the pH Activity Profile of Fungal Laccases, Journal of Biological Chemistry, Vol. 272, No. 2, S. 924–928 (PDF).
- ↑ a b Datenblatt 3,5-Dimethoxy-4-hydroxybenzaldehyd bei Merck, abgerufen am 29. Januar 2012.
- ↑ a b c d e f g h i j k Datenblatt Syringaldehyde, ≥ 98 % bei Sigma-Aldrich, abgerufen am 14. März 2017 (PDF).
- ↑ a b c d e f g h i SYRINGALDEHYDE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 4. Januar 2024.
- ↑ R. Sun, J. Tomkinson, F.C. Mao, X.F. Sun: Physicochemical characterization of lignins from rice straw by hydrogen peroxide treatment. In: J. Appl. Polym. Sci. Band 79, Nr. 4, 2001, S. 719–732, doi:10.1002/1097-4628(20010124)79:4<719::AID-APP170>3.0.CO;2-3.
- ↑ J. Zhang, H. Deng, L. Lin: Wet Aerobic Oxidation of Lignin into Aromatic Aldehydes Catalysed by a Perovskite-type Oxide: LaFe1-xCuxO3 (x=0, 0.1, 0.2). In: Molecules. Band 14, 2009, S. 2747–2757, doi:10.3390/molecules14082747.
- ↑ P.C. Rodrigues Pinto, E.A. Borges da Silva, A.E. Rodrigues: Insights into Oxidative Conversion of Lignin to High-Added-Value Phenolic Aldehydes. In: Ind. Eng. Chem. Res. Band 50, Nr. 2, 2010, S. 741–748, doi:10.1021/ie102132.
- ↑ J.M. Pepper, J.A. MacDonald: The synthesis of syringaldehyde from vanillin. In: Can. J. Chem. Band 31, Nr. 5, 1953, S. 476–483, doi:10.1139/v53-064.
- ↑ a b c EP 155 335 (1985) Ahrens K.-H. Liebenow W., Grafe I. (Ludwig Heuman & Co GmbH); Verfahren zur Herstellung von 3,5-Dimethoxy-4-alkoxybenzaldehyden.
- ↑ a b Percy S. Manchand, Peter S. Belica, Harry S. Wong: Synthesis of 3,4,5-Trimethoxybenzaldehyde, in: Synth. Commun., 1990, 20 (17), S. 2659–2666 (doi:10.1080/00397919008051474).
- ↑ Paul T. Bowman, Edmond I. Ko, and Paul J. Sides: A Potential Hazard in Preparing Bromine-Methanol Solutions , in: Journal of the Electrochemical Society, 1990, 137, S. 1309–1311 Archivierte Kopie ( vom 22. April 2017 im Internet Archive).
- ↑ D. Nobel: The copper-carbon dioxide system, a new mild and selective catalyst for the methoxylation of non-activated aromatic bromides. In: J. Chem. Soc., Chem. Commun. 1993, S. 419–420, doi:10.1039/C39930000419.
- ↑ I.A. Pearl, D.L. Beyer: Reactions of Vanillin and its Derived Compounds. XVII. A Synthesis of Syringaldehyde from Vanillin. In: J. Am. Chem. Soc. Band 74, Nr. 17, 1952, S. 4262–4263, doi:10.1021/ja01137a006.
- ↑ S. Madhavi, Design, synthesis, biochemical and biological evaluation of benzocyclic and enediyne analogs of combretastatins as potential tubulin binding ligands in the treatment of cancer, Ph.D. Thesis, Baylor University, 2007, S. 102 (Abstract ( vom 4. März 2016 im Internet Archive)).
- ↑ Patent US20110245544A1: Process for preparing hydroxy-substituted aromatic aldehydes. Angemeldet am 1. April 2011, veröffentlicht am 6. Oktober 2011, Anmelder: BASF SE, Erfinder: K. Ebel, S. Rüdenauer.
- ↑ C. F. H. Allen, Gerhard W. Leubner: Syringic Aldehyde In: Organic Syntheses. 31, 1951, S. 92, doi:10.15227/orgsyn.031.0092; Coll. Vol. 4, 1963, S. 866 (PDF).
- ↑ A.K. Tripathi, J.K. Sama, S.C. Taneja: An expeditious synthesis of syringaldehyde from p-cresol. In: Indian J. Chem. 49B, 2010, S. 379–381 (PDF).
- ↑ Ragnar, M.; Lindgren, C. T., Nilvebrant N.-O.: pKa-values of Guaiacyl and Syringyl Phenols Related to Lignin, J. Wood Chem. Technol. 2000, 20(3), S. 277–305 (doi:10.1080/02773810009349637, Auszug).
- ↑ a b c d CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b M.N.M. Ibrahim, R.B. Sriprasanthi, S. Shamsudeen, F. Adam, S.A. Bhawani: A concise review of the natural existence, synthesis, properties, and applications of syringaldehyde. In: Bioresources. Band 7, Nr. 3, 2012, S. 4377–4399 (Abstract).
- ↑ O.G. Boundagiou, S.A. Ordoudi, M.Z. Tsimidou: Structure–antioxidant activity relationship study of natural hydroxybenzaldehydes using in vitro assays. In: Food Res. Int. Band 43, Nr. 8, 2010, S. 2014–2019, doi:10.1016/j.foodres.2010.05.021.
- ↑ C. Kelly, O. Jones, C. Barnhart, C. Lajoie: Effect of furfural, vanillin and syringaldehyde on Candida guilliermondii growth and xylitol biosynthesis. In: Appl. Biochem. Biotechnol. Band 148, Nr. 1–3, 2008, S. 97–108, doi:10.1007/s12010-007-8103-1.
- ↑ A.L. Robinson, R. Subramanian, N.M. Donahue, A. Bernardo-Bricker, W.F. Rogge: Source Apportionment of Molecular Markers and Organic Aerosol. 2. Biomass Smoke. In: Environ. Sci. Technol. Band 40, Nr. 24, 2006, S. 7811–7819, doi:10.1021/es060782h.
- ↑ M.A. Bari, G. Baumbach, B. Kuch, G. Scheffknecht: Air Pollution in Residential Areas from Wood-fired Heating. In: Aerosol Air Qual. Res. Band 11, 2011, S. 749–757, doi:10.4209/aaqr.2010.09.0079.
- ↑ Y.-F. Ji, Z.-M. Zong, X.-Y. Wei: Efficient and convenient synthesis of 3,4,5-trimethoxybenzaldehyde from p-cresol. In: Synth. Commun. Band 32, Nr. 18, 2002, S. 2809–2814, doi:10.1081/SCC-120006464 (erowid.org).
- ↑ Patent US6602515B1: Photo stable organic sunscreen compounds with antioxidant properties and compositions obtained therefrom. Angemeldet am 16. Juli 2001, veröffentlicht am 5. August 2003, Anmelder: EM Industries, Erfinder: R.T. Chaudhuri.
- ↑ R.K. Chaudhuri, Z. Lascu, G. Puccetti, A.A. Deshpande, S.K. Paknikar: Design of a photostabilizer having built-in antioxidant functionality and its utility in obtaining broad-spectrum sunscreen formulations. In: Photochem. Photobiol. Band 82, Nr. 3, 2006, S. 823–828, doi:10.1562/2005-07-15-RA-612.
- ↑ Patent US8106233B2: Antioxidant Compounds. Angemeldet am 21. März 2006, veröffentlicht am 31. Januar 2012, Anmelder: Merck Patent GmbH, Erfinder: T. Rudolph, H. Buchholz.
- ↑ T. Rudolph, S. Eisenberg, J. Grumelard, B. Herzog: State-of-the-art Light Protection against Reactive Oxygen Species. In: SOFW-Journal. Band 140, Nr. 3, 2014, S. 9–14 (shopsofw.com).
