Titan(IV)-oxid (Titandioxid) ist das IV-wertige Oxid des Titans. Neben diesem polymorphen Oxid gibt es eine Reihe an nichtstöchiometrischen Suboxiden des Titans, sogenannte Magneli-Phasen sowie das Titan(III)-oxid und Titan(II)-oxid.[8]
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
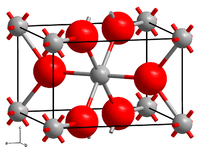
| Titan(IV)-oxid in der Modifikation Rutil _ Ti4+ _ O2− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Titan(IV)-oxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | TiO2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver[4] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 79,866 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
2900 °C[4] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub)[7] | |||||||||||||||||||||
| Toxikologische Daten |
>5,5 mg·l−1 (LC50, Krustentiere, 48 h)[4] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Titandioxid hat als Weißpigment ein weites Einsatzgebiet, daher werden weltweit pro Jahr vier bis fünf Millionen Tonnen produziert.[9] Die Haupteinsatzgebiete liegen im Bereich der Beschichtungen wie Lacke und Anstriche, gefolgt von Kunststoffeinfärbungen und Laminatpapieren. Farbige Produkte enthalten in der Regel auch Weißpigmente, um ein hohes Deckvermögen zu erreichen.
Die Verwendung von Titandioxid als Lebensmittelzusatzstoff ist umstritten, da Gesundheitsrisiken nicht ausgeschlossen werden können.[10] Mit Wirkung zum 7. August 2022 ist die Anwendung von Titandioxid in Lebensmitteln im EWR nicht mehr zulässig.[11][12] Die Schweiz hat ein Verbot per 15. März 2022 beschlossen, jedoch mit einer Übergangsfrist von sechs Monaten.[13] Öko-Test berichtete 2023 von Titandioxid in Kinderzahnpasta.[14]
Geschichte
BearbeitenEntdeckung 1791
BearbeitenNachdem Titan 1791 von William Gregor im Mineral Ilmenit entdeckt und als Menachanite (nach seinem Fund in Manaccan, im südlichen Cornwall) bezeichnet worden war, erkannte Heinrich Klaproth das Titandioxid im Mineral Rutil. Klaproth benannte das Mineral im Jahr 1795 nach der mythologischen Geschichte der Titanen Titanium (gemäß der Theogonie sind Titanen das älteste Göttergeschlecht).
Entdeckung des Sulfatverfahrens 1915
BearbeitenDie Chemiker Peder Farup (1875–1934) und Gustav Jebsen (1861–1923) erfanden ein Verfahren zur Trennung von Titan und Eisen im Mineral Ilmenit. In den 1910er Jahren erfolgten weitere gemeinsame Entdeckungen der beiden norwegischen Chemiker, insbesondere zur Herstellung der anorganischen chemischen Verbindung Titandioxid und im Jahr 1915 zum Sulfatverfahren.[15] Das Verfahren zur Herstellung von Titandioxid wurde zum Patent angemeldet. Heute ist der Sulfatprozess noch immer von Bedeutung. Das Sulfatverfahren ist der häufigste methodische Prozess zur Herstellung von Titandioxid.
Zunehmend industrielle Herstellung und Nutzung
BearbeitenSeit die hervorragende Eignung von Titan als weißes Pigment 1908 in Norwegen und den USA erkannt wurde, setzte auch die industrielle Nutzung ein. Der Chemiker Gustav Jebsen, einer der Entdecker des Sulfatverfahrens, wirkte auch als Industrieller.
Ab 1916 wurde das Pigment unter der Bezeichnung Kronos Titan White kommerziell hergestellt.[16] Bis 1938 wurde Titanweiß nur in der Anatas-Modifikation hergestellt, dann aber zunehmend in der Rutil-Modifikation, da deren photokatalytische Aktivität geringer und die Bewitterungsstabilität der daraus hergestellten Produkte entsprechend höher ist. Für beide Modifikationen ist das Titandioxid geeignet.
Das Weißpigment auf der Basis der Rutil-Modifikation wird auch als Rutilweiß bezeichnet.
Verwendung, Herstellung und Verbreitung heute: Zahlen und Statistiken
BearbeitenMehr als die Hälfte der Produktionsmenge wird in Lacken eingesetzt, gefolgt von Polymeren und Papier.[17] 70 % der Weltproduktion wurde 2014 von fünf Herstellern der westlichen Welt produziert. Neben dem Marktführer Chemours (USA, vorher DuPont) sind dies die Unternehmen Cristal Global (2019 von Tronox übernommen, Saudi-Arabien), Tronox (USA), Venator Materials (Vereinigtes Königreich, ehemals Teil von Huntsman, USA) und Kronos (USA). Der größte Hersteller in Asien ist LomonBillions (Volksrepublik China). Laut einer Darstellung des Unternehmens Venator Materials vom Juni 2018 verfügten die fünf größten westlichen Hersteller über 54 % der weltweiten Produktionskapazität.[18] Die Regionen, die am meisten Titandioxid verbrauchen, sind Europa (1,72 Mio. t), die Volksrepublik China (1,42 Mio. t), Rest-Asien (1 Mio. t) und Nordamerika (0,89 Mio. t).[19]
Vorkommen
BearbeitenTitan(IV)-oxid kommt in der Natur in fünf Modifikationen vor:
- Rutil ist ein in der tetragonalen Raumgruppe P42/mnm (Raumgruppen-Nr. 136) kristallisierendes Mineral von meist prismatischem Habitus mit den Gitterparametern a = 4,59 Å und c = 2,96 Å sowie 2 Formeleinheiten pro Elementarzelle. Seine gemessene Dichte beträgt 4,23 g/cm³. Rutil ist die bedeutendste und einzige bei hohen Temperaturen stabile Modifikation des Titandioxids.
- Anatas kristallisiert ebenfalls tetragonal, jedoch in der höchstsymmetrischen Raumgruppe I41/amd (Nr. 141) (Hermann-Mauguin-Symbol 4/m2/m2/m) mit den Gitterparametern a = 3,78 Å und c = 9,51 Å sowie 4 Formeleinheiten pro Elementarzelle. Er entwickelt meist dipyramidale (tetragonal-oktaedrische) Kristalle von durch Verunreinigungen erzeugter schwarzgrauer, rötlichbrauner oder blauer Farbe. Bei 700 °C wandelt sich Anatas, abhängig von der Atmosphäre und Fremdionen, irreversibel in Rutil um. Die gemessene Dichte von Anatas beträgt zwischen 3,79 und 3,97 g/cm³.
- Brookit kristallisiert in der orthorhombischen Raumgruppe Pbca (Nr. 61) mit den Gitterparametern a = 9,17 Å; b = 5,45 Å und c = 5,14 Å sowie 8 Formeleinheiten pro Elementarzelle. Er entwickelt tafelige bis prismatische Kristalle und hat eine gemessene Dichte zwischen 4,08 und 4,18 g/cm³. Auch Brookit geht unterhalb des Schmelzpunktes in Rutil über. Technisch hat er keine Bedeutung.
- Akaogiit (IMA 2007-058) ist mit einer Dichte von 4,72 g/cm³ ein ultradichter Polymorph von Titandioxid mit der Struktur vom Baddeleyit-Typ, der in geschocktem Granatgneis im Nördlinger Ries entdeckt wurde. Akaogiit kristallisiert monoklin-prismatisch in der Raumgruppe P21/c (Nr. 14) mit den Gitterparametern a = 4,606(2) Å; b = 4,896(3) Å; c = 4,933(3) Å und β = 99,17(6)°.[20]
- Riesit (IMA 2015-110a) ist eine ebenfalls erstmals im Nördlinger Ries entdeckte und nach seiner Typlokalität benannte Hochdruckmodifikation des Titandioxids, die in der monoklinen Raumgruppe P2/c (Nr. 13) mit den Gitterparametern a = 4,519(3) Å; b = 5,503(8) Å; c = 4,888(2) Å und β = 90,59(8)° kristallisiert. Seine Dichte von 4,37 ± 0,11 g/cm³ ist etwas geringer als die von Akaogiit, aber höher als die der anderen Modifikationen.[21]
Weitere Modifikationen
BearbeitenNeben den natürlichen Modifikationen sind acht synthetisch hergestellte Modifikationen bekannt, davon sind drei metastabil (monoklin, tetragonal und orthorhombisch) und fünf Hochdruckmodifikationen (α-PbO2-, Baddeleyit-, Cotunnit- sowie orthorhombische und kubische Strukturen). Die Modifikation mit Cotunnit-Struktur wurde von L. Dubrovinsky et al. als härtestes bekanntes Oxid mit einer Härte nach Vickers von 38 GPa und einem Kompressionsmodul von 431 GPa (zum Vergleich: Diamant hat 442 GPa bis 446 GPa) unter Normaldruck beschrieben.[22] Spätere Studien kamen zu anderen Ergebnissen mit tieferen Werten für die Härte (7–20 GPa, somit weicher als Oxide wie Korund Al2O3 und Rutil)[23] und das Kompressionsmodul (≈ 300 GPa).[24][25]
| Modifikation | Kristallsystem | Herstellung |
|---|---|---|
| TiO2(B)[26] | monoklin | Hydrolyse von K2Ti4O9 mit nachfolgender Temperung |
| TiO2(H), Hollandit-ähnliche Struktur form[27] | tetragonal | Oxidation der Kaliumtitanat-Bronze, K0.25TiO2 |
| TiO2(R), Ramsdellit-ähnliche Struktur[28] | orthorhombisch | Oxidation der Lithiumtitanat-Bronze Li0.5TiO2 |
| TiO2(II)-(α-PbO2-ähnliche Struktur)[29] | orthorhombisch | |
| Baddeleyit-ähnliche Struktur, (7-fach koordiniertes Ti)[30] | monoklin | |
| TiO2 -OI[31] | orthorhombisch | |
| kubische Struktur[32] | kubisch | P > 40 GPa, T > 1600 °C |
| TiO2 -OII, Cotunnit(PbCl2)-ähnliche Struktur[22] | orthorhombisch | P > 40 GPa, T > 700 °C |
Gewinnung und Darstellung
BearbeitenTitandioxid kann im Labor durch Hydrolyse von Ti(IV)-Verbindungen, wie Titanoxidsulfat, Titantetrachlorid oder Metallalkoholaten wie das Titan-tetraisopropylat hergestellt werden:
- Reaktion von Titanoxidsulfat mit Wasser zu Titanoxohydrat und Schwefelsäure
- Reaktion von Titantetrachlorid mit Wasser im ersten Schritt zu Titanoxychlorid und Salzsäure und dann zu Titanoxohydrat und Salzsäure
- Titano-tetraisopropylat und Wasser reagieren zu Titandioxid und Isopropanol
Da die Titansäureester der niederen n-Alkanole zu heftig reagieren, empfiehlt sich die Verwendung der Isopropanol- oder tert-Butanolester.[33] Das so erhaltene Titanoxohydrat, formal TiO(OH)2 oder TiO2xH2O, wird durch Kalzinierung in Anatas oder Rutil überführt, wobei reines, hochgeglühtes Titandioxid stets das Rutilgitter ergibt.[33] Die Verbrennung von Titan(IV)-chlorid mit Sauerstoff wird im Labormaßstab selten angewendet. Sehr reines Titandioxid lässt sich durch Hydrolyse von gereinigtem TiCl4 herstellen.[33]
Da die Hauptmenge des technisch hergestellten TiO2 als Pigment verwendet wird, stören färbende Ionen wie Eisen. Als Erze werden für das Sulfatverfahren in der Regel Ilmenit (FeTiO3) oder titanhaltige Schlacken aus der Elektroreduktion des Ilmenits eingesetzt.[34] Diese Schlacke, genau wie Rutil aus alluvialen Lagerstätten, kann auch im technisch anspruchsvolleren Chloridverfahren eingesetzt werden. Beide Verfahren erhöhen die Reinheit des Titanoxids deutlich. Die Summe der färbenden Ionen liegt in der Regel unter 200 ppm beim Sulfatverfahren, hauptsächlich Niob, untergeordnet Eisen, und weniger als 50 ppm beim Chloridverfahren, Niob und Eisen.
Bei der industriellen Herstellung von Titanoxid aus Ilmenit nach dem Sulfatverfahren entsteht Dünnsäure (verdünnte Schwefelsäure), die meist nach Konzentration für den Ilmenit-Aufschluss wiederverwendet wird. In einigen Ländern wird diese Dünnsäure bis heute zum Teil in Flüsse und Meere geleitet oder verklappt. Die Gewinnung nach dem Chloridverfahren, vorwiegend aus Rutil-Erz oder TiO2-Schlacke, lässt dagegen keine Dünnsäure entstehen. Das verwendete Chlor bleibt weitgehend im Prozesskreislauf. Die in beiden Verfahren entstehenden Eisensalze werden unter anderem zur Chromat-Reduktion in Zementen, Abwasserbehandlung und in Biogas-Anlagen eingesetzt.
Einkristalle
BearbeitenEinkristalle von Rutil werden in der Regel nach dem Verneuil-Verfahren hergestellt.[35] Vereinzelt wird auch das Zonenschmelzverfahren eingesetzt, während das Czochralski-Verfahren als ungeeignet beschrieben wird.[36][37]
Die Herstellung von Anatas-Einkristallen kann nicht aus der Schmelze erfolgen. Hier werden CTR-Verfahren eingesetzt.[38]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenDer Schmelzpunkt von Titandioxid liegt bei 1855 °C, die Verbindung ist thermisch stabil. Titandioxid ist außerdem chemisch inert. Es ist lichtbeständig, preiswert und daher das bedeutendste Weißpigment. Für Lebensmittel war es als Zusatzstoff E 171 zugelassen.
Optische Eigenschaften
BearbeitenDer Brechungsindex von Titanoxid ist hoch, außerdem zeigt es eine große Dispersion. Der Brechungsindex hängt zusätzlich deutlich von der Kristallmodifikation ab. Titandioxid ist doppelbrechend. Dabei erreicht der Unterschied im Brechungsindex zwischen ordentlichem Strahl und außerordentlichem Strahl einen Wert von bis zu .
Aus koloristischer Sicht hat Titandioxid infolge des hohen Brechungsindexes das höchste Deckvermögen aller Weißpigmente und gleichzeitig ein hervorragendes Aufhellvermögen. Das maximale Deckvermögen von Titandioxid liegt bei einer Korngröße von etwa 200 nm bis 300 nm je nach Anwendung und Bezugsgröße, anzahlbezogene oder massenbezogene Größenverteilung.[39][40][41]
Titandioxid ist ein Halbleiter, somit ist am Temperaturnullpunkt das Valenzband voll gefüllt und das Leitungsband unbesetzt. Die Bandlücke ist von der Modifikation abhängig. Lichtquanten mit einer Energie größer als die Bandlücke werden absorbiert. Auch UV-Licht kann ab der entsprechenden Wellenlänge absorbiert und so ein UV-Schutz hergestellt werden. Durch kurzwellige Lichteinstrahlung werden Elektronen aus dem Valenzband in das Leitungsband gehoben und hinterlassen ein Loch. Die Größe der Bandlücke ist von der Kristallrichtung und zusätzlich im Bereich von nanopartikulärem Material von der Teilchengröße abhängig.
| Modifikation | Bandabstand (eV)[42] | Wellenlänge (nm) | interpolierter Brechungsindex bei 589 nm[6] |
|---|---|---|---|
| Anatas | 3,23 | 385 | ne=2,489 no=2,561 |
| Brookit | 3,14 | 395 | nα=2,585 nβ=2,583 nγ=2,702 |
| Rutil | 3,02 | 410 | ne=2,900 no=2,613 |
Dielektrische Eigenschaften
BearbeitenTitandioxid hat eine vergleichsweise hohe Dielektrizitätskonstante. Für Rutil liegt sie bei ε = 111 in der kristallographischen a-Richtung und ε = 257 entlang der c-Achse.[43] Andere Quellen nennen kleinere Werte[44], wobei die Werte von Messparametern wie Frequenz und Temperatur abhängig sind. Anwendungen sind zum Beispiel High-k-Dielektrika.
Chemische Eigenschaften
BearbeitenVon den Titanoxiden ist das Titan(IV)-dioxid die häufigste Verbindung. Es ist chemisch inert und kann nur in heißer Schwefelsäure, Flusssäure und heißen Laugen gelöst werden. Es ist teilweise Ausgangsmaterial für die Herstellung von Titanaten. Bei Beleuchtung mit UV-Licht können photokatalytische Radikalreaktionen stattfinden.
Verwendung
BearbeitenTitandioxid findet überwiegend als weißes, chemisch stabiles Pigment Verwendung und ist im Colour Index unter C.I. Pigment White 6 bzw. C.I. 77891 aufgeführt.
Pigment
BearbeitenTitandioxid hat einen Brechungsindex, der deutlich größer als der der meisten organischen Stoffe ist, die zur Bindung von Farben eingesetzt werden. Das bedeutet, dass Pigmente aus Titanoxid das Licht effektiv streuen, so dass sich eine gut deckende weiße Farbe ergibt. Dabei liegt die optimale Größe der Pigmente im Bereich von 200 nm bis 300 nm. Der Größenbereich ergibt sich aus der Mie-Theorie. Die Partikelgröße beeinflusst zum einen die Deckkraft und zum anderen den Farbton, feinteiligere Pigmente erscheinen blaustichiger. Die wichtigsten Anwendungen sind mit rund 60 % Marktanteil Beschichtungsmaterialien und 25 % Polymer-Anwendungen. Titandioxid findet auch in der Ölmalerei Verwendung. Zu den technischen Anwendungsgebieten von Titandioxid, auf die rund 80 Prozent des gesamten Verbrauchs entfallen, zählen Farben und Lacke, Kunststoffe und Textilien; gebraucht wird es auch bei der Papierherstellung zur Erzielung eines hohen Weißgrades.
Reines Titandioxid kommt dabei außer als E 171 kaum zum Einsatz, da neben der UV-Schutzwirkung durch das TiO2 lichtinduzierte chemische Radikal-Reaktionen stattfinden. Durch eine Funktionalisierung der Pigmentkörner wird dieser Effekt vermindert und gleichzeitig eine Verbesserung der Farbeigenschaften, in der Regel durch einfachere Dispergierung, erreicht.[45] Einige Anwendungen, z. B. für Fasern oder Zementanwendungen, verwenden trotz der höheren photochemischen Aktivität Anatas-Pigmente, während die Mehrzahl der Anwendungen auf Rutil-Pigmente zurückgreift.
Lebensmittel
BearbeitenIn Deutschland wurde Titandioxid durch die Farbstoff-Verordnung ab 1959 als Lebensmittelfarbstoff für die Verwendung in Lebensmitteln zugelassen.[46] Zur Übernahme der Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in nationales Recht wurde die Farbstoff-Verordnung 1966 angepasst und für Titandioxid die E-Nummer E 171 aufgenommen.[47] Ab 1978 wurde die Verwendung in Deutschland durch die Zusatzstoff-Zulassungsverordnung geregelt. Durch die Verordnung (EG) Nr. 1333/2008, die am 20. Januar 2009 in Kraft trat, wurde die Verwendung von Titandioxid als Lebensmittelzusatzstoff im ganzen EWR einheitlich geregelt.[48] Als Europäische Verordnung gilt diese unmittelbar in allen Mitgliedsstaaten, nationale entgegenstehende Regelungen sind nicht zulässig. In der Schweiz, wo die lebensmittelrechtliche Zulassung durch die Zusatzstoffverordnung (ZuV) (Stand: Juli 2020[49]) geregelt wird, war Titandioxid ab 1979 als Lebensmittelfarbstoff zugelassen.[50]
Titandioxid wird weltweit beispielsweise als Aufheller für Zahnpasta, Kaugummi, Süßwaren, Käse oder Saucen sowie als Trennmittel eingesetzt.[51] In der EU und der Schweiz war die Anwendung von E 171 als Farbstoff Gruppe II: Lebensmittelfarbstoffe ohne Höchstmengenbeschränkung in zahlreichen Anwendungen zugelassen.[52][49]
Im Jahr 2020 setzte Frankreich die Verwendung von Titandioxid als Zusatzstoff in Lebensmitteln aus.[53] Im Mai 2021 stufte die Europäische Behörde für Lebensmittelsicherheit (EFSA) Titandioxid als nicht sicher für den menschlichen Verzehr ein, da eine negative Wirkung auf das menschliche Erbgut nicht ausgeschlossen werden kann.[10][54][55] Mit Wirkung zum 7. Februar 2022 wurde die genehmigte Anwendung von Titandioxid als Lebensmittelzusatzstoff aus der Verordnung (EG) Nr. 1333/2008 gestrichen. Lebensmittel, die entsprechend der vorher gültigen Fassung vor diesem Datum produziert wurden, durften bis zum 7. August 2022 in Verkehr gebracht werden und bis zu ihrem Mindesthaltbarkeits- oder Verbrauchsdatum auf dem Markt bleiben.[11] In der Schweiz mussten titandioxidhaltige Lebensmittel seit dem 1. Mai 2021 den Vermerk Nano in der Zutatenliste tragen,[53] bis die Verwendung verboten wurde.[50] Einige Hersteller verzichteten bei ausgewählten Produkten freiwillig vorher auf den umstrittenen Farbstoff.[56] Im März 2022 teilte das Bundesamt für Lebensmittelsicherheit und Veterinärwesen mit, dass das Verbot per 15. März 2022, mit einer Übergangsfrist von sechs Monaten, in Kraft tritt.[13]
Kosmetika
BearbeitenTitandioxid-Pigmente werden in Kosmetika sowie als UV-Blocker in Sonnencremes verwendet.[57] In der EU ist die Verwendung von Titandioxid in Kosmetika durch die Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel geregelt. In der aktuellen Fassung (Stand: Februar 2022) ist Titandioxid als Farbstoff (Nummer 143 in Anhang VI) und als UV-Filter (Nummer 27 in Anhang VI) zugelassen. Dabei gibt es Einschränkungen für Titandioxid mit mindestens 1 % Partikel mit aerodynamischem Durchmesser ≤ 10 μm in pulverförmigen Anwendungen (Nummer 321 in Anhang III), um eine Exposition der Lunge durch Inhalation zu verhindern.
Medikamente
BearbeitenÜber 30.000 Medikamente enthalten Titandioxid.[58] Die EU-Kommission hat im Mai 2021 angekündigt, die EU-Arzneimittelbehörde EMA um eine Untersuchung zu bitten, ob und wie sich Titandioxid in Medikamenten ersetzen lässt. Laut Bundesinstitut für Arzneimittel und Medizinprodukte enthalten ca. 32 % der in Deutschland zugelassenen „festen oralen Darreichungsformen“ Titandioxid.[58] Nachdem im Februar 2022 Anwendungen für Titandioxid als Lebensmittelzusatzstoff aus der Verordnung (EG) Nr. 1333/2008 gestrichen wurden, bleibt dessen Verwendung in Medikamenten aufgrund der wissenschaftlichen Analyse der EMA und zur Vermeidung von Arzneimittelengpässen vorerst weiter erlaubt.[11] Allerdings sind Pharmaunternehmen angehalten, Anstrengungen zu unternehmen, Titandioxid durch andere Stoffe zu ersetzen. Innerhalb von drei Jahren soll geprüft werden, ob E 171 weiterhin in der EU-Liste der Lebensmittelzusatzstoffe zur ausschließlichen Verwendung als Farbstoff in Arzneimitteln notwendig ist oder es von dieser Liste gestrichen werden kann. Die EMA als zuständige Behörde ist dazu angehalten, vor dem 1. April 2024 eine erneute Bewertung zum Titandioxid vorzulegen.[11]
Photokatalysator
BearbeitenViele Hersteller bieten Photokatalysatoren auf TiO2-Basis an. Dies sind in der Regel Anatase, Anatas-Rutil-Mischungen oder dotierte Titandioxide mit vielfältigen Anwendungsmöglichkeiten.[59][60][61][62][63] Die Photokatalyse ist eine heterogene Katalyse, bei der unter UV-Beleuchtung gasförmige oder gelöste Stoffe per Radikalreaktion oder Ladungsträgerübergang an Titandioxid oder anderen Stoffen reagieren. Durch die Beleuchtung mit UV-Licht, dessen Energie größer als die Bandlücke ist, oder durch die weniger effiziente Anregung aus den Störstellen einer Dotierung werden freie Ladungsträger, Elektronen im Leitungsband und Löcher im Valenzband, erzeugt. In der Regel rekombinieren diese Ladungsträgerpärchen sehr schnell, allerdings kann durch die Bandverbiegung im Bereich der Oberfläche eine Ladungsträgertrennung erfolgen. Diese reagieren in der Regel mit adsorbiertem Sauerstoff und Wasser zu Hydroxi- und Peroxi-Radikalen.[64] In der Regel, außer bei direkten Ladungsübergängen zu Adsorbaten, reagieren die Radikale mit adsorbierten Organika. Die Reaktionspfade bis zur vollständigen Mineralisierung können sehr komplex sein und viele Photonenanregungen benötigen.[65]
Bei der Außenanwendung, als Beispiel sei die photokatalytische Selbstreinigung genannt, wird in der Regel der UV-Anteil des Sonnenlichts ASTM 1.5 von etwa 3 % ausgenutzt, maximal etwa 35 W/m2.[66] Innenanwendungen fallen meist ungünstiger aus, zum einen ist der UV-Anteil sehr gering oder bei dotierten Katalysatoren ist die Reaktionsrate gering. Die Kenngrößen in der Photokatalyse sind verschieden definierte Quantenausbeuten. Typische Werte können kaum angegeben werden, da sehr viele Parameter in die Katalyse eingehen. Meist werden aber Größenordnungen von 1 Reaktion auf 1000 Photonen genannt.[67][68] Ein weiteres Problem dabei ist, dass die photokatalytischen Reaktionen keine Unterscheidung zwischen der organischen Bindermatrix und den Schadstoffen machen. Ungeeignete Bindersysteme neigen daher zu einer frühen Kreidung.
Sonstige Anwendungen
BearbeitenBei der Herstellung von optischem Glas wird TiO2 zur Beeinflussung der optischen Dispersion (siehe Abbe-Zahl) eingesetzt; in vielen Flintgläsern ersetzt es das früher verwendete Blei(II)-oxid. Titandioxid in der Anatas-Modifikation ist Hauptbestandteil der Katalysatoren, die für die industrielle Entstickung von Rauchgasen nach dem SCR-Verfahren eingesetzt werden. Auf den Halbleitereigenschaften des Titandioxids basiert die Farbstoffsolarzelle (Grätzel-Zelle). Mit Hilfe von Titandioxid gelang die Herstellung von Memristoren.[69] Titandioxid wird ebenfalls als Hauptbestandteil des Keramik-Dielektrikums in Klasse-1-Keramikkondensatoren eingesetzt. Synthetische Rutil-Einkristalle werden aufgrund ihrer optischen Eigenschaften für optische Prismen oder als Diamantimitate eingesetzt. Die Imitate sind aber aufgrund der Doppelbrechung leicht zu erkennen. Darüber hinaus wird Titandioxid zur Herstellung von Prüfaerosolen verwendet.[70][71]
Bei den Wimbledon Championships und anderen Tenniswettbewerben, die auf Gras ausgetragen werden, wird eine Masse, die Titandioxid enthält, zum Markieren der Linien auf dem Tennisplatz verwendet. Mit einem Transferradmarker wird eine weiße Masse (jährlicher Verbrauch: rund 1900 Liter) aufgetragen. Alle Linien sind 50 mm breit, mit Ausnahme der Grundlinien, die 100 mm breit sind.
Nachweis
BearbeitenIn der Kälte frisch gefälltes Titandioxid ist amphoter und in verdünnten Mineralsäuren löslich. Ein Aufschluss erfolgt mit Kaliumhydrogensulfat im Porzellantiegel. Anschließend wird in kaltem Wasser mit etwas Schwefelsäure gelöst. Mit einigen Tropfen Wasserstoffperoxid bildet sich das gelbe (basisch) bis gelborange (sauer, Foto) [Ti(O2)·aq]2+-Kation.
Datierung
BearbeitenBei stratigraphischen Untersuchungen an 115 Jahre alten, etwa 15 mal lackierten Wiener Stadtbahngeländern von Otto Wagner wurde das erstmalige Auftreten von Rutilweiß zur Datierung von Lackschichten genutzt.[72]
Risiken
BearbeitenTitandioxid ist nicht als wassergefährdend eingestuft.[4]
Der Ausschuss für Risikobewertung (RAC) der ECHA bewertete im Juni 2017 den Einstufungsvorschlag der französischen Behörde, die die Einstufung und Kennzeichnung als „wahrscheinlich krebserzeugend beim Menschen“ (Carc 1B) vorgeschlagen hatte, und kam zum Ergebnis, dass Titandioxid als krebsverdächtig bei inhalativer Aufnahme einzustufen ist (Carc 2). Dieser Einstufungsvorschlag musste von der Europäischen Kommission geprüft und in geltendes Recht umgesetzt werden.[73] Drei Farbenhersteller klagten beim Europäischen Gericht gegen diese Einstufung. Am 23. November 2022 erklärte das EuG die Regelung für nichtig. Denn erstens habe sich der RAC und anschließend auch die EU-Kommission auf eine wissenschaftliche Studie verlassen, die die Dichte der fraglichen Partikel nicht korrekt berechnet habe. Und zweitens sei gegen das Kriterium verstoßen worden, wonach sich die Einstufung eines Stoffes als karzinogen nur auf einen Stoff beziehen darf, der die intrinsische Eigenschaft hat, Krebs zu erzeugen, d. h. die Kanzerogenität müsse dem Stoff eigen sein. Bei Titandioxid hingegen bestehe die Gefahr der Karzinogenität nur in Verbindung mit bestimmten lungengängigen Partikeln, wenn sie in einem bestimmten Aggregatzustand, einer bestimmten Form, einer bestimmten Größe und einer bestimmten Menge vorhanden seien; sie zeige sich nur bei einer Lungenüberlastung und entspreche einer Partikeltoxizität.[74]
Sehr hohe Konzentrationen von Nanopartikeln, also Partikeln mit weniger als 100 nm, führen in der Lunge zu Immunreaktionen.[75] Die Immunreaktion wird mit der Möglichkeit eines entzündungsbasierten Krebsrisikos diskutiert, wobei oftmals mit nanopartikulärem TiO2 kleiner 100 nm getestet wird und pigmentäres TiO2 größer 200 nm als Beispielanwendung und für die Produktionsmenge herangezogen wird.[76]
In einer Gruppe aus 56 Personen, die selektiv aufgrund von Problemen mit Titan-Implantaten ausgewählt wurden, zeigten 21 Personen eine positive Reaktion im MELISA-Test (Lymphozytentransformationstest) mit TiO2, während alle 54 Personen der Gruppe, die mittels Patch-Test getestet wurden, negativ getestet wurden.[77] In einer Studie der University of North Carolina wurde herausgefunden, dass Titandioxid-Nanopartikel giftig für Microglia-Gehirnzellen bei Mäusen sind.[78]
Bei Versuchen von Biologen an der Universität Koblenz-Landau mit Daphnien (Wasserflöhe) wurden teilweise deutliche Effekte trotz geringer Titandioxid-Konzentrationen im Wasser festgestellt:[79] Die eingesetzten Konzentrationen bis zu 2 mg/l lagen im Versuch um einen Faktor von bis zu über 1000 über der in der Umwelt vermuteten Konzentration von ng/l bis wenigen µg/l. Die primäre Wirkung erfolgte über eine Anlagerung von Partikeln an den Chitinpanzer der Wasserflöhe mit in der Versuchsgruppe tödlichen Folgen.[80] Die nächste Generation der Daphnien zeigte in den Studien über einen nicht interpretierten und analysierten Wirkungsmechanismus ebenfalls Schädigungen.[81] Diese Untersuchungen stehen teilweise im direkten Widerspruch zu einer älteren Studie mit noch deutlich höheren Konzentrationen bis 50 mg/l.[82]
In Ratten wurden vom INRA nach 100 Tagen oraler Titandioxid-Verabreichung u. a. Darmentzündungen festgestellt. Die Dosis von 10 mg/kg entspricht laut den Autoren der Menge, der Menschen durch die Verwendung als Lebensmittelfarbe E 171 ausgesetzt sein können.[83] Auch eine andere Studie zeigt, dass Darmentzündungen durch E 171 verstärkt werden können.[84][85]
Untersuchungen zur Zytotoxizität von photokatalytisch aktiven Titandioxid-Nanopartikeln ergaben: Nanopartikel aus Titandioxid können unter Absorption von UV-Strahlung reaktive Radikale bilden, die in der Lage sind, viele organische Substanzen abzubauen. Diese Eigenschaft bietet zahlreiche industrielle Anwendungen, birgt aber auch das Risiko schädlicher Auswirkungen auf lebende Organismen.[86]
Einstufung als „Vermutlich krebserzeugend bei Inhalation“
Bearbeiten| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| Name |
Gemische in Form von Puder mit einem Gehalt von mindestens 1 % Titandioxid in Partikelform oder eingebunden in Partikel mit einem aerodynamischen Durchmesser von ≤ 10 μm | |||||||
| CAS-Nummer | ||||||||
| EG-Nummer |
236-675-5 | |||||||
| ||||||||
| Toxikologische Daten |
>5,5 mg·l−1 (LC50, Krustentiere, 48 h)[87] | |||||||
Titan(IV)-oxid wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Titan(IV)-oxid waren die Besorgnisse bezüglich anderer gefahrenbezogener Bedenken sowie der vermuteten Gefahren durch krebserregende Eigenschaften und der möglichen Gefahr durch mutagene Eigenschaften. Die Neubewertung läuft seit 2018 und wird von Frankreich durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert.[89]
Nachdem Titandioxid bei Tierversuchen zu Entzündungen geführt und Forscher darüber hinaus krebserregende Eigenschaften vermutet hatten, entschloss sich Frankreich 2019, die Verwendung in Lebensmitteln ab 2020 zu verbieten.[90]
Eine mögliche Gesundheitsgefahr wird vor allem im Einatmen von Stäuben gesehen, dies war Gegenstand zahlreicher Diskussionen. Im Oktober 2019 beschloss die EU-Kommission eine Einstufung und Kennzeichnung von Titandioxid in Pulverform mit mindestens 1 % Partikel mit aerodynamischem Durchmesser ≤ 10 μm als vermutlich karzinogen für den Menschen (Kategorie 2) durch Einatmen (H351 i).[91] Am 18. Februar 2020 wurde die vorgeschlagene Einstufung von Titandioxid im Rahmen der 14. ATP (Adaption to technical progress) in der Verordnung (EU) Nr. 2020/217 verabschiedet und war damit zum 1. Oktober 2021 verbindlich umzusetzen.[92][91]
Nachdem der deutsche Hersteller CWS Powder Coatings Klage erhoben hatte, erklärte der Gerichtshof der Europäischen Union im November 2022 die Delegierte Verordnung der Europäischen Kommission aus dem Jahr 2019 für nichtig, soweit sie die harmonisierte Einstufung und Kennzeichnung von Titandioxid in bestimmten Pulverformen als karzinogener Stoff bei Einatmen betrifft. Eine Gefahr für Krebs besteht laut Gericht nur in Verbindung mit bestimmten lungengängigen Titandioxidpartikeln, wenn sie in einem bestimmten Aggregatzustand, einer bestimmten Form, einer bestimmten Größe und einer bestimmten Menge vorhanden seien. Das reiche für die pauschale Einstufung von Titandioxid als krebserregend nicht aus. Unberührt von dem Urteil bleibt das Verbot der Verwendung in Nahrungsmitteln. Das Urteil ist noch nicht rechtskräftig.[93][94]
Weblinks
Bearbeiten- zusatzstoffe-online.de: Titandioxid
- Bundesamt für Lebensmittelsicherheit und Veterinärwesen: Titandioxid
- Dossiers zum Thema Titandioxid angeboten von Zahnärztliche Mitteilungen
Einzelnachweise
Bearbeiten- ↑ Eintrag zu E 171: Titanium dioxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- ↑ Eintrag zu CI 77891 in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. November 2021
- ↑ Eintrag zu TITANIUM DIOXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 5. August 2020.
- ↑ a b c d e f g h i Eintrag zu Titan(IV)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu Titandioxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ a b T. Radhakrishnan: The optical properties of titanium dioxide. In: Proceedings of the Indian Academy of Sciences - Section A. Band 35, Nr. 3, 1952, S. 117–125, doi:10.1007/BF03172227.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 13463-67-7 bzw. Titandioxid), abgerufen am 2. November 2015.
- ↑ Univ. Freiburg Vorlesungsscript Chemie, Oxide Teil 4: Nichtstöchiometrische binäre Oxide.
- ↑ United States Geological Survey USGS TITANIUM MINERAL CONCENTRATES (englisch; PDF; 27 kB).
- ↑ a b EFSA: Titandioxid: E 171 gilt bei Verwendung als Lebensmittelzusatzstoff nicht mehr als sicher. 6. Mai 2021, abgerufen am 11. Mai 2021.
- ↑ a b c d Verordnung (EU) 2022/63 der Kommission vom 14. Januar 2022 zur Änderung der Anhänge II und III der Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates hinsichtlich des Lebensmittelzusatzstoffs Titandioxid (E 171)
- ↑ Martin Rücker: Gefährlicher Weißmacher. Für Lebensmittel wird der krebsverdächtige Farbstoff Titandioxid verboten. In: Frankfurter Rundschau, 11. April 2022, S. 16. Online (abgerufen am 13. April 2023).
- ↑ a b Ab Herbst 2022 ist Titandioxid als Lebensmittelzusatzstoff in der Schweiz verboten. In: admin.ch. Bundesamt für Lebensmittelsicherheit und Veterinärwesen, 9. März 2022, abgerufen am 2. Mai 2022.
- ↑ Anja Gribhofer: Titandioxid in Kinderzahnpasta: Was Eltern jetzt wissen sollten. In: rnd.de. 31. Januar 2023, abgerufen am 7. Februar 2023.
- ↑ NorWhite. In: TiO2 Project. 2023, abgerufen am 13. April 2023 (englisch).
- ↑ Die Produktion erfolgte in der Mine Titania AS im norwegischen Sokndal und die Herstellung ab 1916 in der Fabrik Kronos Titan AS im norwegischen Fredrikstad, vgl. tio2project.com (abgerufen am 13. April 2023).
- ↑ T. Brock, M. Groteklaes, P. Mischke; Lehrbuch der Lacktechnologie; 2. Auflage; Vincentz Network; Hannover; 2000; ISBN 3-87870-569-7; S. 123.
- ↑ Joseph Chang: TiO2 players in major asset shuffle. In: ICIS Explore. Abgerufen am 28. März 2023 (amerikanisches Englisch).
- ↑ Chemours: TiO2 Market Consumption (S. 9), Key Competitors and Technology (S. 13), September 2015 (Datenstand 2014)
- ↑ A. El Goresy, L. Dubrovinsky, P. Gillet, G. Graup, M. Chen: Akaogiite: An ultra-dense polymorph of TiO2 with the baddeleyite-type structure, in shocked garnet gneiss from the Ries Crater, Germany. In: American Mineralogist. Band 95, 2010, S. 892–895 (englisch, rruff.info [PDF; 747 kB; abgerufen am 13. Februar 2022]).
- ↑ Oliver Tschauner, Chi Ma, Antonio Lanzirotti, Matthew G. Newville: Riesite, a New High Pressure Polymorph of TiO2 from the Ries Impact Structure. In: Minerals. Band 10, Nr. 1, 2020, S. 78–85, doi:10.3390/min10010078.
- ↑ a b L. S. Dubrovinsky, N. A. Dubrovinskaia, V. Swamy, J. Muscat, N. M. Harrison, R. Ahuja, B. Holm, B. Johansson: Materials science: The hardest known oxide. In: Nature. 410. Jahrgang, Nr. 6829, 2001, S. 653–654, doi:10.1038/35070650, PMID 11287944.
- ↑ Oganov A.R., Lyakhov A.O.: Towards the theory of hardness of materials. In: J. of Superhard Materials. 32. Jahrgang, Nr. 3, 2010, S. 143–147, doi:10.3103/S1063457610030019.
- ↑ Y. Al-Khatatbeh, K. K. M. Lee and B. Kiefer: High-pressure behavior of TiO2 as determined by experiment and theory. In: Phys. Rev. B. 79. Jahrgang, Nr. 13, 2009, S. 134114, doi:10.1103/PhysRevB.79.134114.
- ↑ Nishio-Hamane D., Shimizu A., Nakahira R., Niwa K., Sano-Furukawa A., Okada T., Yagi T., Kikegawa T.: The stability and equation of state for the cotunnite phase of TiO2 up to 70 GPa. In: Phys. Chem. Minerals. 37. Jahrgang, Nr. 3, 2010, S. 129–136, doi:10.1007/s00269-009-0316-0.
- ↑ Marchand R., Brohan L., Tournoux M.: A new form of titanium dioxide and the potassium octatitanate K2Ti8O17. In: Materials Research Bulletin. 15. Jahrgang, Nr. 8, 1980, S. 1129–1133, doi:10.1016/0025-5408(80)90076-8.
- ↑ M. Latroche, L. Brohan, R. Marchand, M. Tournoux: New hollandite oxides: TiO2(H) and K0.06TiO2. In: Journal of Solid State Chemistry. 81. Jahrgang, Nr. 1, 1989, S. 78–82, doi:10.1016/0022-4596(89)90204-1.
- ↑ J. Akimoto, Y. Gotoh, Y. Oosawa, N. Nonose, T. Kumagai, K. Aoki, H. Takei: Topotactic Oxidation of Ramsdellite-Type Li0.5TiO2, a New Polymorph of Titanium Dioxide: TiO2(R). In: Journal of Solid State Chemistry. 113. Jahrgang, Nr. 1, 1994, S. 27–36, doi:10.1006/jssc.1994.1337.
- ↑ P. Y. Simons, F. Dachille: The structure of TiO2II, a high-pressure phase of TiO2. In: Acta Crystallographica. 23. Jahrgang, Nr. 2, 1967, S. 334–336, doi:10.1107/S0365110X67002713.
- ↑ Sato H. , Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K: Baddeleyite-Type High-Pressure Phase of TiO2. In: Science. 251. Jahrgang, Nr. 4995, 1991, S. 786–788, doi:10.1126/science.251.4995.786, PMID 17775458.
- ↑ Dubrovinskaia N A, Dubrovinsky L S., Ahuja R, Prokopenko V B., Dmitriev V., Weber H.-P., Osorio-Guillen J. M., Johansson B: Experimental and Theoretical Identification of a New High-Pressure TiO2 Polymorph. In: Phys. Rev. Lett. 87. Jahrgang, 27 Pt 1, 2001, S. 275501, doi:10.1103/PhysRevLett.87.275501, PMID 11800890.
- ↑ Mattesini M, de Almeida J. S., Dubrovinsky L., Dubrovinskaia L, Johansson B., Ahuja R.: High-pressure and high-temperature synthesis of the cubic TiO2 polymorph. In: Phys. Rev. B. 70. Jahrgang, Nr. 21, 2004, S. 212101, doi:10.1103/PhysRevB.70.212101.
- ↑ a b c Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1366.
- ↑ C. Murty, R. Upadhyay, S. Asokan: Eletro Smelting of Ilmenite for Production of TiO2 Slag. (PDF; 715 kB).
- ↑ Firma Djeva ( vom 11. August 2014 im Internet Archive) Broschüre über die Züchtung nach dem Verneuil-Verfahren (deutsch, 4,2 MB PDF).
- ↑ Kazuhito Hatta, Mikio Higuchi, Junichi Takahashi, Kohei Kodaira, „Floating zone growth and characterization of aluminum-doped rutile single crystals“, Journal of Crystal Growth, 163, 1996, S. 279–284; doi:10.1016/0022-0248(95)00972-8.
- ↑ H. Machida und T. Fukuda: „Difficulties encountered during the Czochralski growth of TiO2 single crystals“, Journal of Crystal Growth, 112, 1991, S. 835–837; doi:10.1016/0022-0248(91)90142-R.
- ↑ T. Sekiya und S. Kurita, „Defects in Anatase Titanium Dioxide“, Nano- and Micromaterials-Advances in Materials Research, 2008, Volume 9, S. 121–141, doi:10.1007/978-3-540-74557-0_4.
- ↑ Polymere, Licht und die Wissenschaft von TiO2 DuPont ( vom 11. Mai 2011 im Internet Archive). (1,42 MB PDF).
- ↑ Erik Shepard Thiele: Scattering of electromagnetic radiation by complex microstructures in the resonant regime. 1998 (case.edu [PDF; 3,2 MB] Ph.D. Thesis, University of Pennsylvania).
- ↑ J. Winkler: Titandioxid. Vincentz Network, Hannover 2003, ISBN 3-87870-738-X, S. 55.
- ↑ Michael Grätzel, Francois P. Rotzinger: The Influence of the Crystal Lattice Structure on the conduction Band Energy of Oxides of Titanium(IV). In: Chemical Physics Letters. Vol. 118, Nr. 5, 1985, S. 474–477.
- ↑ Bora Lee, Choong-ki Lee, Cheol Seong Hwang und Seungwu Han: Influence of exchange-correlation functionals on dielectric properties of rutile TiO2, in: Current Applied Physics, Band 11 (2011), S293–S296. doi:10.1016/j.cap.2010.11.104.
- ↑ Rebecca A. Parker: Static Dielectric Constant of Rutile (TiO2 ), 1.6-1060°K. In: Physical Review. Band 124, Nr. 6, 1961, S. 1719–1722, doi:10.1103/PhysRev.124.1719.
- ↑ Fa. KRONOS Titan: Einsatzgebiete von TiO2 (PDF; 374 kB).
- ↑ BGBl. 1959 I S. 756 vom 19. Dezember 1959
- ↑ BGBl. 1966 I S. 74 vom 20. Januar 1966
- ↑ Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe.
- ↑ a b Verordnung des EDI über die zulässigen Zusatzstoffe in Lebensmitteln. (PDF) Das Eidgenössische Departement des Innern (EDI), 1. Juli 2020, abgerufen am 20. Dezember 2020.
- ↑ a b Bundesamt für Lebensmittelsicherheit und Veterinärwesen: Titandioxid. In: blv.admin.ch. 6. Mai 2021, abgerufen am 20. Februar 2022.
- ↑ Titandioxid in Lebensmitteln. Titanium Dioxide Manufacturers Association (TDMA), abgerufen am 11. Mai 2021.
- ↑ Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe in der konsolidierten Fassung vom 8. August 2021.
- ↑ a b Gesundheitsgefährdende Nanopartikel als Lebensmittelzusatzstoffe verbieten. In: parlament.ch. 2019, abgerufen am 28. Januar 2021.
- ↑ Lebensmittelsicherheit: EU-Kommission schlägt Zulassungstopp für Titandioxid vor. In: Zeit online. 6. Mai 2021, abgerufen am 11. Mai 2021.
- ↑ Titanium Dioxide / Titandioxid / CI 77891 | voraussichtliches Verbot. In: skriptorium. Abgerufen am 24. Mai 2021 (deutsch).
- ↑ Peter Fritsche: Umstrittener Farbstoff – Titandioxid verschwindet aus immer mehr Produkten. Schweizer Radio und Fernsehen (SRF), 26. April 2021, abgerufen am 26. April 2021.
- ↑ Ceresana: Marktstudie Titandioxid, abgerufen am 21. Mai 2013.
- ↑ a b Jost Maurin: Ruf nach Verbot von Titandioxid: Unsicherer Farbstoff in Tabletten. In: taz.de. 30. Mai 2021, abgerufen am 20. Februar 2022.
- ↑ Fa. Sachtleben: Hombikat UV 100.
- ↑ Evonik: Aerosil, Aeroxid P25 ( vom 1. Juli 2012 im Internet Archive).
- ↑ KRONOS Titan: Kronoclean Datenblatt (PDF; 488 kB).
- ↑ Neue Zürcher Zeitung: „Pflastersteine gegen Smog“, Übersichtsartikel, 16. November 2011.
- ↑ Fraunhofer Allianz Photokatalyse: „Biological efficiency measurements for photocatalyst“ ( vom 24. Januar 2016 im Internet Archive) (engl. PDF; 79 kB).
- ↑ Tusnelda E. Doll: „Photochemischer und photokatalytischer Abbau von Carbamazepin, Clofibrinsäure, Iomeprol und Iopromid“, Dissertation, 2004, DNB 1002433525/34.
- ↑ Martin Lindner: „Optimierung der photokatalytischen Wasserreinigung mit Titandioxid: Festkörper- und Oberflächenstruktur des Photokatalysators“, Dissertation, DNB 954460030/34.
- ↑ Renewable Resource Data Center: Sonnenlichtspektrum ASTM 1.5.
- ↑ Thorsten Ebbinghaus: „Kombinierter biologisch-photokatalytischerAbbau von umweltrelevanten Stickstoffverbindungen zur Reinigung von landwirtschaftlichen Abwässern mit bewachsenen Pflanzen-filtern und TiO2/UV“, TU Dortmund, Dissertation, 2002 (PDF; 1,5 MB).
- ↑ Martin Klare: „Möglichkeiten des photokatalytischen Abbaus umweltrelevanter Stickstoffverbindungen unter Einsatz von TiO2“, TU Dortmund, Dissertation, 1999 (PDF; 3,3 MB).
- ↑ Kevin Bullis: Neuverdrahtung der Elektronik. Technology Review. 8. Mai 2008, abgerufen am 25. März 2010.
- ↑ VDI 3491 Blatt 3:2018-03 Messen von Partikeln; Herstellungsverfahren für Prüfaerosole; Dispergierung von Haufwerken und Feststoffen (Measurement of particles; Methods for generating test aerosols; Dispersing solid materials). Beuth Verlag, Berlin. S. 7.
- ↑ VDI 3491 Blatt 9:1989-09 Messen von Partikeln; Herstellen von Prüfaerosolen mittels eines Bürstendosierers (Particulate matter measurement; generation of test aerosols with a rotating brush generator). Beuth Verlag, Berlin. S. 5.
- ↑ Otto Wagner und das Grün der 50er Jahre : Sehgewohnheiten und Wirklichkeit orf.at, 31. Dezember 2017, abgerufen am 31. Dezember 2017.
- ↑ ECHA-Pressemitteilung vom 9. Juni 2017
- ↑ CURIA Dokumente: Verbundene Rechtssachen T‑279/20, T‑288/20 und T‑283/20 CWS Powder Coatings GmbH u. a. gegen Europäische Kommission. Urteil des Gerichts (Neunte erweiterte Kammer) vom 23. November 2022. Abgerufen am 24. November 2022.
- ↑ nanopartikel.info: Nanocare, Broschüre, Seite 11 ff. (deutsch, PDF; 2,7 MB).
- ↑ Yazdi, A. S.; Guarda, G.; Riteau, N.; Drexler, S. K.; Tardivel, A.; Couillin, I.; Tschopp, J. (2010). Nanoparticles activate the NLR pyrin domain containing 3 (Nlrp3) inflammasome and cause pulmonary inflammation through release of IL-1 and IL-1. Proceedings of the National Academy of Sciences 107 (45): S. 19449–19454, doi:10.1073/pnas.1008155107, PMC 2984140 (freier Volltext).
- ↑ Biodenth.be (PDF; 245 kB) K. Müller, E. Valentine-Thon: „Hypersensitivity to titanium: Clinical and laboratory evidence“ ( vom 9. November 2013 im Internet Archive) Neuroendocrinology Letters, Vol. 27, Suppl. 1, 2006, S. 31–35.
- ↑ T. C. Long, N. Saleh, R. D. Tilton, G. V. Lowry, B. Veronesi: Titanium dioxide (P25) produces reactive oxygen species in immortalized brain microglia (BV2): implications for nanoparticle neurotoxicity. In: Environmental Science & Technology. Band 40, Nummer 14, Juli 2006, S. 4346–4352. PMID 16903269.
- ↑ Mirco Bundschuh, Frank Seitz, Ricki R. Rosenfeldt, Ralf Schulz, Elena A. Rozhkova: Titanium Dioxide Nanoparticles Increase Sensitivity in the Next Generation of the Water Flea Daphnia magna. In: PLoS ONE. 7, 2012, S. e48956, doi:10.1371/journal.pone.0048956.
- ↑ Volker Mrasek: deutschlandfunk.de: Einfluss sogar über Generationen hinweg (22. März 2014).
- ↑ Nadja Podbregar: Generationsübergreifende Folgen: Nanobelastung von Kleinkrebsen macht ihre Nachkommen übersensibel. In: scinexx.de. 8. März 2013, abgerufen am 20. August 2019.
- ↑ Kerstin Hund-Rinke, Markus Simon: Ecotoxic Effect of Photocatalytic Active Nanoparticles (TiO2) on Algae and Daphnids Environmental science and pollution research international : ESPR 13 (2006), No. 4, S. 225–232, doi:10.1065/espr2006.06.311.
- ↑ Bettini, S. et al.: Food-grade TiO2 impairs intestinal and systemic immune homeostasis, initiates preneoplastic lesions and promotes aberrant crypt development in the rat colon. Scientific Reports 7, Article number: 40373 (2017), doi:10.1038/srep40373.
- ↑ Titandioxid-Nanopartikel können Darmentzündungen verstärken. In: media.uzh.ch. Universität Zürich, 19. Juli 2017, archiviert vom ; abgerufen am 14. Oktober 2023.
- ↑ Pedro A Ruiz, Belen Morón u. a.: Titanium dioxide nanoparticles exacerbate DSS-induced colitis: role of the NLRP3 inflammasome. In: Gut 66, 2017, S. 1216–1224. doi:10.1136/gutjnl-2015-310297.
- ↑ C. Kasper, J. Z. Bloh, S. Wagner, D. W. Bahnemann, T. Scheper: Untersuchungen zur Zytotoxizität von photokatalytisch aktiven Titandioxid-Nanopartikeln. In: Chemie Ingenieur Technik. 82, 2010, S. 335, doi:10.1002/cite.200900057.
- ↑ a b Eintrag zu Titan(IV)-oxidin Pulverform mit mindestens 1 % Partikel mit aerodynamischem Durchmesser ≤ 10 μm in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Eintrag zu Titanium dioxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Titanium dioxide, abgerufen am 6. März 2022.
- ↑ Frankreich verbietet umstrittenen Weißmacher Titandioxid. Spiegel Online, 17. April 2019.
- ↑ a b Titandioxid: Es besteht noch Forschungsbedarf. Bundesinstitut für Risikobewertung, 29. Juli 2020.
- ↑ Verordnung (EU) 2020/217
- ↑ curia.europa.eu Urteil des Europäischen Gerichtshofs vom 23. November 2022 (T-279/20), abgerufen am 2. Januar 2023.
- ↑ Für eine Zusammenfassung siehe Pressemitteilung des Gerichts, abgerufen am 2. Januar 2023.