Ligandenkegelwinkel
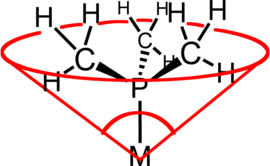
Der Ligandenkegelwinkel (ein gebräuchliches Beispiel ist der Tolman-Kegelwinkel oder θ) ist eine Methode, um den sterischen Anspruch eines Liganden in einem Übergangsmetallkomplex zu bestimmen. Er ist als Raumwinkel definiert, den das Metall am Scheitelpunkt und den äußersten Enden der Van-der-Waals-Radien am Umfang des Kegels bilden (siehe Abbildung). Gewöhnlicherweise werden tertiäre Phosphanliganden anhand dieses Parameters klassifiziert, allerdings kann die Methode auf jeden Liganden angewendet werden. Die Bezeichnung Kegelwinkel wurde erstmals von Chadwick A. Tolman, einem forschenden Chemiker bei DuPont, eingeführt. Ursprünglich entwickelte er diese Methode für Phosphanliganden in Nickelkomplexen und bestimmte sie anhand von Messungen akkurater physikalischer Modelle.[1][2][3]
Asymmetrische Fälle
BearbeitenDas Konzept von Kegelwinkeln ist anhand von symmetrischen Liganden wie PR3 am einfachsten zu verstehen. Allerdings wurde der Ansatz verfeinert, um weniger asymmetrische Liganden vom Typ PRR′R″ sowie Diphosphane einzubeziehen. In solchen asymmetrischen Fällen wird das Mittel der Hälfte der Winkel, θi/2 zwischen den Substituenten genommen, um den gesamten Kegelwinkel θ zu finden. Im Falle von Diphosphanen wird θi/2 näherungsweise als die Hälfte des Winkels, den die Phosphoratome mit dem Zentralatom bilden, beschrieben. Diese liegen für Diphosphane mit Methylenrückgrat bei etwa 74°, im Falle eines Ethylenrückgrats bei etwa 85° und im Falle eines Diphosphans mit Propylenrückgrat bei 90°.
Der Manz-Kegelwinkel ist häufig einfacher zu berechnen als der Tolman-Kegelwinkel:[4]
| Ligand | Angle (°) |
|---|---|
| PH3 | 87[1] |
| PF3 | 104[1] |
| P(OCH3)3 | 107[1] |
| dmpe | 107 |
| depe | 115 |
| P(CH3)3 | 118[1] |
| dppm | 121 |
| dppe | 125 |
| dppp | 127 |
| P(CH2CH3)3 | 132[1] |
| dcpe | 142 |
| P(C6H5)3 | 145[1] |
| P(cyclo-C6H11)3 | 179[1] |
| P(t-Bu)3 | 182[1] |
| P(C6F5)3 | 184[1] |
| P(C6H4-2-CH3)3 | 194[1] |
| P(2,4,6-Me3C6H2)3 | 212 |
Variationen
BearbeitenDer Tolman-Kegelwinkel benötigt empirische Bindungsdaten und definiert den Durchmesser als die maximal mögliche Umschreibung eines idealisierten, frei drehbaren Substituenten. Der Metal–Ligand-Abstand in Tolmans Modell wurde empirisch aus den Kristallstrukturen von tetraedrischen Nickelkomplexen erhalten. Im Gegensatz dazu erhält das Fest-Winkel-Konzept sowohl Bindungslänge und Durchmesser aus empirischen Festkörperkristallstrukturen.[5] Vorteile, haben beide Systeme.
Ist die Geometrie eines Liganden bekannt, entweder durch Kristallographie oder computerchemische Rechnungen, kann ein exakter Kegelwinkel bestimmt werden.[6][7][8] Im Gegensatz zu Tolmans Methode werden dabei keine Annahmen benötigt.
Anwendungen
BearbeitenDas Konzept des Kegelwinkels ist praktisch in der homogenen Katalyse relevant, da die Größe des Liganden die Reaktivität des angehängten Metallzentrums beeinflusst. In einem bekannten[9] Beispiel wird die Selektivität einer katalytischen Hydroformylierung stark von der Größe der Coliganden beeinflusst. Obwohl sie monovalent sind, können einige Phosphine mehr als die Hälfte der Koordinationssphäre eines Metallzentrums einnehmen.
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k Chadwick A. Tolman: Phosphorus ligand exchange equilibriums on zerovalent nickel. Dominant role for steric effects. In: J. Am. Chem. Soc. 92. Jahrgang, Nr. 10, 1. Mai 1970, S. 2956–2965, doi:10.1021/ja00713a007.
- ↑ C. A. Tolman, W. C. Seidel, L. W. Gosser: Formation of three-coordinate nickel(0) complexes by phosphorus ligand dissociation from NiL4. In: J. Am. Chem. Soc. 96. Jahrgang, Nr. 1, 1. Januar 1974, S. 53–60, doi:10.1021/ja00808a009.
- ↑ Tolman, C. A.: Steric Effects of Phosphorus Ligands in Organometallic Chemistry and Homogeneous Catalysis. In: Chem. Rev. 77. Jahrgang, Nr. 3, 1977, S. 313–48, doi:10.1021/cr60307a002.
- ↑ T. A. Manz, K. Phomphrai, G. Medvedev, B. B. Krishnamurthy, S. Sharma, J. Haq, K. A. Novstrup, K. T. Thomson, W. N. Delgass, J. M. Caruthers, M. M. Abu-Omar: Structure-Activity Correlation in Titanium Single-Site Olefin Polymerization Catalysts Containing Mixed Cyclopentadienyl/Aryloxide Ligation. In: J. Am. Chem. Soc. 129. Jahrgang, Nr. 13, 2007, S. 3776–3777, doi:10.1021/ja0640849, PMID 17348648.
- ↑ Tobias Niksch, Helmar Görls, Wolfgang Weigand: The Extension of the Solid-Angle Concept to Bidentate Ligands. In: Eur. J. Inorg. Chem. 2010. Jahrgang, Nr. 1, 2009, S. 95–105, doi:10.1002/ejic.200900825.
- ↑ Jenna A. Bilbrey, Arianna H. Kazez, J. Locklin, Wesley D. Allen: Exact ligand cone angles. In: J. Comput. Chem. 34. Jahrgang, Nr. 14, 2013, S. 1189–1197, doi:10.1002/jcc.23217, PMID 23408559.
- ↑ CCQC. In: Ccqc.uga.edu. Archiviert vom am 17. Juni 2016; abgerufen am 2. Juni 2016.
- ↑ Michel Petitjean: Analytical Algorithms for Ligand Cone Angles Calculations. Application to Triphenylphosphine Palladium Complexes. In: Comptes Rendus Chimie. 18. Jahrgang, Nr. 6, 2015, S. 678–684, doi:10.1016/j.crci.2015.04.004.
- ↑ D. Evans, J. A. Osborn, G. Wilkinson: Hydroformylation of Alkenes by Use of Rhodium Complex Catalyst. In: J. Chem. Soc. 33. Jahrgang, Nr. 21, 1968, S. 3133–3142, doi:10.1039/J19680003133.