Tantal(V)-bromid
Tantal(V)-bromid ist eine anorganische chemische Verbindung des Tantals aus der Gruppe der Bromide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
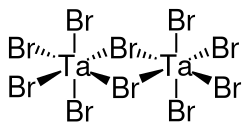
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tantal(V)-bromid | |||||||||||||||
| Andere Namen |
Tantalpentabromid | |||||||||||||||
| Summenformel | TaBr5 | |||||||||||||||
| Kurzbeschreibung |
feuchtigkeitsempfindlicher gelber Feststoff mit charakteristischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 580,49 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,989 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
348,8 °C[1] | |||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenTantal(V)-bromid kann durch Reaktion von Tantal mit Brom bei 230–250 °C gewonnen werden.[2]
Alternativ kann es durch Reaktion von Tantal(V)-oxid mit Tetrabrommethan oder Aluminium(III)-bromid gewonnen werden.[2]
Eigenschaften
BearbeitenTantal(V)-bromid ist ein sehr feuchtigkeitsempfindlicher, an Luft rauchender[3], gelber Feststoff mit charakteristischem Geruch.[1] Er besitzt eine monokline Kristallstruktur isotyp zu derjenigen von α-Niob(V)-chlorid mit der Raumgruppe C2/m (Raumgruppen-Nr. 12) und 6 Formeleinheiten in der Elementarzelle (a = 1943,3 pm, b = 1877,5 pm, c = 620,3 pm, β = 90,72°). Die Struktur von Tantal(V)-bromid wurde 1958 erstmals von R. F. Rolsten beschrieben, der jedoch eine orthorhombische Kristallstruktur mit der Raumgruppe Pbma (Nr. 57, Stellung 5) ermittelte. Es ist wie Tantal(V)-iodid aus dimeren Molekülen aufgebaut.[4]
Verwendung
BearbeitenTantal(V)-bromid kann als Katalysator in organischen Synthesen verwendet werden.[5]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i Datenblatt Tantal(V) bromide, 99.9% (metals basis) bei Alfa Aesar, abgerufen am 21. Juni 2013 (Seite nicht mehr abrufbar).
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1455.
- ↑ Jean d'Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 752 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Katja Habermehl; Neue Untersuchungen an Halogeniden des Niobs und Tantals (PDF; 3,9 MB), urn:nbn:de:hbz:38-31032, 22. April 2010.
- ↑ Julio Alvarez-Builla, Juan José Vaquero, José Barluenga: Modern Heterocyclic Chemistry. 4 Volumes. John Wiley & Sons, 2011, ISBN 978-3-527-33201-4, S. 1542 (eingeschränkte Vorschau in der Google-Buchsuche).

