| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Ladenburg-Umlagerung | |||||
| Albert Ladenburg | 1888 | Alkyl/Benzylpyridiniumhalogenide | Umlagerung durch Erhitzen | Alkyl-/Benzylpyridine | [1] |
| Lander-Umlagerung | |||||
| George Druce Lander | 1900 | Alkylimidate, Iodmethan | Umlagerung | N-Alkylamide | [2][3] |

| |||||
| Lapworth-Kondensation | |||||
| Arthur Lapworth | 1903 | Arylaldehyde, Cyanid (Katalysator) | Kondensation | α-Hydroxyketone | [4] |
| Larock-Indolsynthese | |||||
| Richard C. Larock | 1991 | ortho-Iodaniline, Alkine, Palladium(II)-acetat | palladium-katalysierte Anellierung | Indole | [5] |

| |||||
| Lebedew-Prozess | |||||
| Sergei Wassiljewitsch Lebedew | 1933 | Ethanol, Magnesiumoxid-Aluminiumoxid-Silikat-Katalysator | Dehydrierung zu Acetaldehyd, Dimerisierung zu Crotonaldehyd, Reaktion mit Ethanol | Butadien | [6] |
| Lederer-Manasse-Rektion | |||||
| siehe Baekeland-Manasse-Lederer-Reaktion | |||||
| Lehmstedt-Tănăsescu-Reaktion | |||||
| Ioan Tănăsescu, Kurt Lehmstedt | 1927 | 2-Nitrobenzaldehyd, Aromaten, Natriumnitrit, Schwefelsäure | Cyclisierung | Acridone | [7][8] |

| |||||
| Lemieux-Johnson-Oxidation | |||||
| Raymond Urgel Lemieux, William Summer Johnson | 1956 | Alkene, Osmiumtetroxid, Natriumperiodat | oxidative Spaltung | Aldehyde | [9] |

| |||||
| Lemieux-von-Rudloff-Oxidation | |||||
| Raymond Urgel Lemieux, Ernst von Rudloff | 1955 | Alkene, Kaliumpermanganat, Natriumperiodat | oxidative Spaltung | Aldehyde, Carbonsäuren | [10] |
| Letts-Nitrilsynthese | |||||
| Edmund A. Letts | 1872 | aromatische Carbonsäuren, Metallthiocyanate | Substitution unter CO2-Abspaltung | aromatische Nitrile | [11] |

| |||||
| Leuckart-Thiophenol-Reaktion | |||||
| Rudolf Leuckart | 1890 | Xanthogensäureester, Kalilauge | Spaltung | Thiophenole | [12] |

| |||||
| Leuckart-Wallach-Reaktion | |||||
| Rudolf Leuckart, Otto Wallach | 1885 | Ketone/Aldehyde, Amine, Ameisensäure | reduktive Aminierung | tertiäre Amine | [13][14] |

| |||||
| Levinstein-Prozess | |||||
| benannt nach der Firma von Ivan Levinstein | 1. WK | Ethen, Dischwefeldichlorid | Senfgas | [15] | |
| Ley-Oxidation | |||||
| Steven Ley | 1987 | Alkohole, Tetrapropylammoniumperruthenat, N-Methylmorpholin-N-oxid | Oxidation | Ketone/Aldehyde | [16] |
| Liebeskind-Srogl-Kupplung | |||||
| Lanny S. Liebeskind, Jiri Srogl | 2000 | Boronsäuren, Thioester, Pd(0)-Komplex, Cu(I)-Verbindung | Kupplungsreaktion | Bildung einer C-C-Verbindung | [17] |
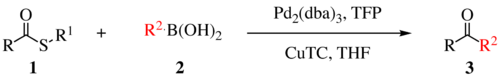
| |||||
| Lindlar-Hydrierung | |||||
| Herbert Lindlar | 1952 | Alkine, Wasserstoff, Lindlar-Katalysator | selektive Hydrierung | Alkene | [18] |

| |||||
| Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung | |||||
| C. A. Lobry de Bruyn, W. A. van Ekenstein | 1885 | Aldosen/Ketosen, Säure | Umlagerung | Ketosen/Aldosen | [19] |

| |||||
| Lombardo-Methylenierung (Takai-Lombardo-Reaktion) | |||||
| Luciano Lombardo | 1982 | Ketone, Lombardo-Reagenz (Zink, Titan(IV)-chlorid, Dibrommethan) | Methenylierung | Alkene | [20] |

| |||||
| Lossen-Abbau | |||||
| Wilhelm Lossen | 1872 | Carbonsäurehydroxylamide, Base | Deprotonierung, Abspaltung von Carboxylat | Isocyanate | [21] |

| |||||
| Luche-Reaktion | |||||
| Jean Louis Luche | 1985 | Aldehyde/Ketone, Allylhalogenide, Zink | Kupplungsreaktion | Homoallylalkohole | [22] |
| Luche-Reduktion | |||||
| Jean-Louis Luche | 1981 | α,β-ungesättigte Ketone, Cer(III)-chlorid, Natriumborhydrid | Reduktion | Allylalkohole | [23] |

| |||||
- ↑ A. Ladenburg: Ueber Pyridin- und Piperidinbasen. In: Justus Liebig's Annalen der Chemie. 247, 1888, S. 1–98, doi:10.1002/jlac.18882470102.
- ↑ H. L. Wheeler und T. B. Johnson: On the rearrangement of imidoesters In: American Chemical Journal 21, 1899, S. 185.
- ↑ G. D. Lander: Alkylation by means of dry silver oxide and alkyl halides In: Journal of the Chemical Society, Transactions 77, 1900, S. 729, doi:10.1039/CT9007700729.
- ↑ Arthur Lapworth: XCVI.—Reactions involving the addition of hydrogen cyanide to carbon compounds. In: Journal of the Chemical Society Transactions. 1903, Band 83, S. 995–1005 doi:10.1039/CT9038300995.
- ↑ Richard C. Larock, Eul Kgun Yum: Synthesis of indoles via palladium-catalyzed heteroannulation of internal alkynes. In: Journal of the American Chemical Society. 113, 1991, S. 6689–6690, doi:10.1021/ja00017a059.
- ↑ Sergei Wassiljewitsch Lebedew. In: Zh. Obshch. Khim. 3, 1933, S. 698.
- ↑ Ioan Tănăsescu: Bull Soc Chim Fr. Band 41, 1927, S. 528.
- ↑ Kurt Lehmstedt: Eine einfache Synthese des Acridons und 3-substituierter Acridone (IX. Mitteil. über Acridin). In: Berichte der deutschen chemischen Gesellschaft. 65, 1932, S. 834, doi:10.1002/cber.19320650531.
- ↑ Raphael Pappo, David Allen, R. U. Lemieux, WS Johnson: Notes - Osmium Tetroxide-Catalyzed Periodate Oxidation of Olefinic Bonds. In: Journal of organic chemistry. 1956, Band 21, Nummer 4, S. 478–479 doi:10.1021/jo01110a606.
- ↑ R. U. Lemieux, E. von Rudloff: PERIODATE–PERMANGANATE OXIDATIONS: I. OXIDATION OF OLEFINS. In: Canadian journal of chemistry. 1955, Band 33, Nummer 11, S. 1701–1709 doi:10.1139/v55-208.
- ↑ E. A. Letts: Neue Bildungsweisen der Amide und Nitrile. In: Berichte der deutschen chemischen Gesellschaft. 5, 1872, S. 669, doi:10.1002/cber.18720050228.
- ↑ Rudolf Leuckart: Eine neue Methode zur Darstellung aromatischer Mercaptane. In: Journal für Praktische Chemie. 41, 1889, S. 179, doi:10.1002/prac.18900410114.
- ↑ R. Leuckart: Ueber eine neue Bildungsweise von Tribenzylamin. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 2341, doi:10.1002/cber.188501802113.
- ↑ O. Wallach: Zur Kenntniss der Terpene und der ätherischen Oele; Zweiundzwanzigste Abhandlung. I. Ueber die Bestandtheile des Tujaöls. In: Justus Liebig's Annalen der Chemie. 272, 1893, S. 99, doi:10.1002/jlac.18932720103.
- ↑ Rudolph Macy, G. N. Jarman, A. B. Morrison, E. Emmet Reid: The Polysulfides in Levinstein Process Mustard Gas. In: Science. 1947, Band 106, Nummer 2755, S. 355–359 doi:10.1126/science.106.2755.355.
- ↑ William P. Griffith, Steven V. Ley, Gwynne P. Whitcombe, Andrew D. White: Preparation and use of tetra-n-butylammonium per-ruthenate (TBAP reagent) and tetra-n-propylammonium per-ruthenate (TPAP reagent) as new catalytic oxidants for alcohols. In: Journal of the Chemical Society, Chemical Communications. 1987, S. 1625, doi:10.1039/C39870001625.
- ↑ Lanny S. Liebeskind, Jiri Srogl: Thiol Ester−Boronic Acid Coupling. A Mechanistically Unprecedented and General Ketone Synthesis. In: Journal of the American Chemical Society. 122, 2000, S. 11260, doi:10.1021/ja005613q.
- ↑ H. Lindlar: Ein neuer Katalysator für selektive Hydrierungen. In: Helvetica chimica acta. 1952, Band 35, Nummer 2, S. 446–450 doi:10.1002/hlca.19520350205.
- ↑ C. A. Lobry de Bruyn, W. Alberda van Ekenstein: Action des alcalis sur les sucres, II.Transformation des sucres sous l'influence de l'hydroxyde de plomb. In: Recueil des Travaux Chimiques des Pays-Bas. 14, 1895, S. 203, doi:10.1002/recl.18950140703.
- ↑ Luciano Lombardo: Methylenation of carbonyl compounds with Zn/CH2Br2/TiCl4. Application to gibberellins. In: Tetrahedron letters. 1982, Band 23, Nummer 41, S. 4293–4296 doi:10.1016/S0040-4039(00)88728-6.
- ↑ W. Lossen: Ueber Benzoylderivate des Hydroxylamins. In: Annalen der Chemie und Pharmacie. 161, 1872, S. 347, doi:10.1002/jlac.18721610219.
- ↑ Christian Pétrier, Jean Louis Luche: Allylzinc reagents additions in aqueous media. In: Journal of organic chemistry. 1985, Band 50, Nummer 6, S. 910–912 doi:10.1021/jo00206a047.
- ↑ Andre L. Gemal, Jean Louis Luche: Lanthanoids in organic synthesis. 6. Reduction of α-enones by sodium borohydride in the presence of lanthanoid chlorides: synthetic and mechanistic aspects. In: Journal of the American Chemical Society. 103, 1981, S. 5454, doi:10.1021/ja00408a029.