| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| MacDonald-Fischer-Abbau | |||||
| Donald L. MacDonald, Hermann O. L. Fischer | 1952 | Hexosen, Ethanthiol, Perphthalsäure, Hydrazin | Bildung eines Dithioacetals, Oxidation, Reaktion mit Hydrazin, Benzaldehyd-Spaltung | Pentosen | [1] |
| MacDonald-Kondensation | |||||
| S. F. MacDonald | 1960 | Pyrrole, Pyrrolaldehyde, Säure, Sauerstoff | Kondensation, Oxidation | Porphyrine | [2] |
| Madelung-Indolsynthese | |||||
| Walter Madelung | 1912 | ortho-Alkyl-N-acylaniline, Base | intramolekulare Cyclisierung | Indole | [3] |

| |||||
| Maillard-Reaktion | |||||
| Louis Camille Maillard | 1912 | Aminverbindungen in Lebensmitteln | Bräunungsreaktion in Hitze | Melanoidine | [4] |
| Maitland-Japp-Reaktion | |||||
| William Maitland, Francis Robert Japp | 1904 | Ketone, Aldehyde | Kondensation | Tetrahydropyranone | [5] |

| |||||
| Majetich-Annelierung | |||||
| George Majetich | 1985 | Allylsilane, Fluoride/Lewis-Säuren | intramolekulare Cyclisierung | Cycloalkane | [6] |
| Makosza-Reaktion | |||||
| Mieczysław Mąkosza | 1983 | Nitroaromaten, Carbanionen, Base | nucleophile Substitution | alkylierte Nitroaromaten | [7] |

| |||||
| Makosza-Indolsynthese | |||||
| Mieczysław Mąkosza | 1997 | ortho-Nitroarylethane, Base, Zink | Cyclisierung, Reduktion | Indole | [8] |
| Malaprade-Reaktion | |||||
| Léon Malaprade | 1928 | cis-Diole, meta-Periodsäure | Oxidation | Carbonylverbindungen | [9] |

| |||||
| Mannich-Reaktion | |||||
| Carl Mannich | 1917 | CH-acide Verbindungen, Aldehyde, primäre/sekundäre Amine | Aminoalkylierung | Mannich-Basen | [10] |

| |||||
| Marciniec-Kupplung | |||||
| Bogdan Marciniec | 2007 | Bis-(Vinyldimethylsilyl)aromaten, 1,4-Divinylbenzol, Rhodium-Katalysator | Kupplung | Silyl-verbrückte Polymere | [11] |
| Marckwald-asymmetrische Synthese | |||||
| Willy Marckwald | 1904 | 2-Ethyl-2-methylmalonsäure, Brucin | thermische Decarboxylierung | 2-Methylbuttersäure | [12] |
| Markó-Lam-Desoxygenierung | |||||
| István E. Markó, Kevin Lam | 2008 | Hydroxygruppen, p-Toluoylchlorid, Samarium(II)-iodid/HMPA oder Elektrolyse | Veresterung, Reduktion | Alkylgruppen | [13] |

| |||||
| Marschalk-Reaktion | |||||
| Charles Henri Marschalk | 1936 | phenolische Anthrachinone, Aldehyd, Base, Natriumdithionit | Deprotonierung, Aldoladdition, Aldolkondensation, Abspaltung von Hydroxid, Reduktion | ortho-substituierte phenolische Anthrachinone | [14] |

| |||||
| Marshall-Boronat-Fragmentierung | |||||
| James Marshall | 1966 | Bicyclodecene, Diboran, Alkoholate | Grob-Fragmentierung | Cyclodecadiene | [15] |
| Martinet-Dioxindolsynthese | |||||
| A. Guyot, J. Martinet | 1913 | Anilin, Mesoxalsäureester, Base | nukleophiler Angriff, Cyclisierung, Abspaltung von Alkoholen, CO2 | Dioxindole | [16] |

| |||||
| Masamune-Macrolactonisierung | |||||
| Satoru Masamune | 1977 | Hydroxythioester, Silber-, Quecksilber oder Kupfersalze | Cyclisierung | Macrolactone | [17] |
| Matsuda-Reaktion | |||||
| Tsutomu Matsuda | 1977 | Aryldiazoniumverbindungen, Alkene, Palladium-Katalysator | Heck-Reaktion | Arylalkene | [18] |
| Mattox-Kendall-Reaktion | |||||
| Vernon R. Mattox, Edward C. Kendall | 1948 | α-Bromketone, Phenylhydrazin | Eliminierung von HBr | α, β-ungesättigte Ketone | [19] |

| |||||
| Mattox-Umlagerung | |||||
| Vernon R. Mattox | 1952 | Steroide mit 1,7-Dihydroxyaceton-Seitenkette, Säure | Eliminierung von Wasser | 1,7-Glyoxal-Derivate | [20] |
| McCormack-Cycloaddition | |||||
| William B. McCormack | 1953 | 1,3-Butadien, Dichlorphosphane | Cycloaddition | Phospholenoxide | [21] |

| |||||
| McFadyen-Stevens-Reaktion | |||||
| John S. McFayden, Thomas Stevens Stevens | 1936 | aromatische Hydrazide, Natriumcarbonat | Reduktion | aromatische Aldehyde | [22] |

| |||||
| McLafferty-Umlagerung | |||||
| Fred McLafferty | 1959 | Doppelbindungshaltige Radikalkationen | Umlagerung | Abspaltung von Neutralmolekülen | [23] |

| |||||
| McMurry-Reaktion | |||||
| John E. McMurry | 1974 | Aldehyde/Ketone, Titan(III)-chlorid/Titan(IV)-chlorid, Reduktionsmittel | Kupplungsreaktion | Alkene | [24] |

| |||||
| Mead-reduktive-Cyclisierung | |||||
| Keith T. Mead | 1993 | 2-Oxetanone, Säure | Ringöffnung, reduktive Cyclisierung | Tetrahydrofurane | [25] |
| Meerwein-Arylierung | |||||
| Hans Meerwein | 1939 | Aryldiazoniumhalogenide, Alkene, Kupfer(II)-halogenid (Katalysator) | Arylierung | Arylalkene | [26] |
| Meerwein-Ponndorf-Verley-Reduktion | |||||
| Hans Meerwein, Wolfgang Ponndorf, Albert Verley | 1925 | Aldehyde/Ketone, Isopropanol, Aluminiumisopropanolat | Reduktion | Alkohole | [27][28][29] |

| |||||
| Meinwald-Umlagerung | |||||
| Jerrold Meinwald | 1963 | Epoxide, Lewis-Säure | Umlagerung | Carbonylverbindungen | [30] |
| Meisenheimer-Umlagerung | |||||
| Jakob Meisenheimer | 1919 | Aminoxide | [1,2]- oder [2-3]-Umlagerung | Alkoxyamine | [31] |

| |||||
| Menke-Nitrierung | |||||
| Jean Baptiste Menke | 1925 | Aromaten, Kupfer(II)-nitrat, Essigsäureanhydrid | aromatische Substitution | Nitroaromaten | [32] |

| |||||
| Menschutkin-Reaktion | |||||
| Nikolai Menschutkin | 1890 | Amine, Halogenalkane | quartäre Ammoniumsalze | [33] | |

| |||||
| Mentzer-Pyronsynthese | |||||
| Charles Mentzer | 1946 | Phenole, β-Ketoester/Malonate | Pyrone/Flavone | [34] | |
| Merrifield-Synthese | |||||
| Robert Bruce Merrifield | 1963 | N-geschützte Aminosäuren, Dicyclohexylcarbodiimid, Trifluoressigsäure | Festphasen-Peptidsynthese | Peptide | [35] |
| Meth-Cohn-Chinolinsynthese | |||||
| O. Meth-Cohn | 1978 | Acylanilide, Phoshorylchlorid, Dimethylformamid | Vilsmeier-Haack-Reaktion, Ringschluss | 2-Chlor-3-substituierte Chinoline | [36] |
| Meyer-Reaktion | |||||
| G. Meyer | 1883 | Natriumstannit/-arsenit/-plumbit, Halogenalkane | Alkylstannonsäuren/-arsonsäuren/-plumbonsäuren | [37] | |
| Meyer-Hartmann-Reaktion | |||||
| Victor Meyer, Christoph Hartmann | 1894 | Iodoxybenzole, Iodosobenzole, Silber(I)-oxid | Diaryliodonium-Salze | [38] | |

| |||||
| Meyers Oxazolin-Methode | |||||
| Albert I. Meyers | 1974 | Oxazoline, LDA, Halogenalkane | Deprotonierung, nukleophile Addition | Bildung einer C-C-Bindung | [39] |
| Meyers-Aldehydsynthese | |||||
| Albert I. Meyers | 1969 | Dihydro-1,3-oxazine, Butyllithium, Halogenalkane, Natriumborhydrid | Deprotonierung, Alkylierung, Reduktion | Aldehyde | [40] |

| |||||
| Meyers Lactamisierung | |||||
| Albert I. Meyers | 1997 | Oxocarbonsäuren, Aminoalkohole | Cyclisierung | Bicyclolactame | [41] |
| Meyer-Schuster-Umlagerung | |||||
| Kurt H. Meyer, Kurt Schuster | 1922 | Propargylalkohole, Säure | Umlagerung | α,β-ungesättigte Ketone | [42] |

| |||||
| Michael-Addition | |||||
| Arthur Michael | 1887 | α,β-ungesättigte Carbonylverbindung, Nukleophil | nukleophile Addition | Bildung einer Bindung zwischen α,β-ungesättigter Carbonylverbindung und Nukleophil | [43] |

| |||||
| Michaelis-Arbuzow-Phosphonatsynthese | |||||
| siehe Arbusow-Reaktion | |||||
| Michaelis-Becker-Reaktion | |||||
| August Michaelis, Thomas Becker | 1897 | Hydrogenphosphonate , Base, Halogenalkan | Deprotonierung, nukleophile Substitution | Alkylphosphonate | [44] |

| |||||
| Michael-Stetter-Reaktion | |||||
| siehe Stetter-Reaktion | |||||
| Midland-Alpine-Boran-Reduktion | |||||
| Mark Midland | 1977 | Carbonylverbindungen, Alpine-Boran | asymetrische Reduktion | enantioselektive Alkohole | [45] |
| Miescher-Abbau | |||||
| Karl Miescher | 1944 | Gallensäuren, Phenylmagnesiumbromid, Säure, N-Bromsuccinimid, Chromtrioxid | Grignard-Reaktion, Eliminierung, Bromierung, Eliminierung, Oxidation | Ketone | [46] |

| |||||
| Migita-Kosugi-Stille-Kupplung | |||||
| siehe Stille-Kupplung | |||||
| Mignonac-Reaktion | |||||
| Georges Mignonac | 1921 | Aldehyde/Ketone, Ammoniak, Wasserstoff, Nickel | katalytische Hydrierung | primäre Amine | [47] |
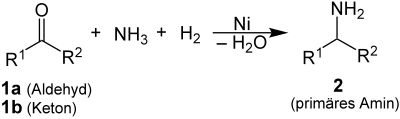
| |||||
| Milas-Hydroxylierung | |||||
| Nicholas A. Milas | 1936 | Alkene, Wasserstoffperoxid, Osmium(VIII)-oxid | Oxidation | cis-Diole | [48] |

| |||||
| Minisci-Reaktion | |||||
| Francesco Minisci | 1971 | (Hetero)aromaten, Carbonsäuren, Silbersalz, Oxidationsmittel | radikalische Substitution | alkylierte Aromaten | [49] |

| |||||
| Mislow-Evans-Umlagerung | |||||
| Kurt Mislow, David Evans | 1970 | α-substituierte Allylsulfoxide, Thiophil | Umlagerung | Alkenole | [50][51] |

| |||||
| Mitsunobu-Reaktion | |||||
| Oyo Mitsunobu | 1967 | Alkohole, Triphenylphosphin, DEAD/DIAD/DMAD | Betain-Bildung, Deprotonierung, nukleophile Substitution | Ester/Ether/Amine/Thioether | [52] |

| |||||
| Mitsunobu-Cyclodehydratisierung | |||||
| benannt nach Oyo Mitsunobu | 2007 | Diole, Triphenylphosphin, DIAD | Mitsunobu-Reaktion | Epoxide | [53] |
| Miyaura-Borylierung | |||||
| Norio Miyaura | 1995 | Halogenaromaten, Tetraalkoxydiborane, Pd(0)-Verbindung (Katalysator) | Borierung | (Hetero)Arylborester | [54] |
| Mizoroki‐Heck-Reaktion | |||||
| siehe Heck-Reaktion | |||||
| Moffatt-Oxidation | |||||
| siehe Pfitzner-Moffatt-Oxidation | |||||
| Moffatt-Swern-Oxidation | |||||
| siehe Swern-Oxidation | |||||
| Moiseev-Reaktion | |||||
| Ilya Moiseev | 1960 | Ethen, Essigsäure, Sauerstoff, Palladium-Katalysator | Oxidation | Vinylacetat | [55] |
| Montgomery-Kupplung | |||||
| John Montgomery | 1997 | Aldehyde, Alkine, Nickel-Komplex, Organosilan/-boran/zinkverbindung/-zirconiumverbindung | Kupplung | Allylalkohole | [56] |
| Moore-Cyclisierung | |||||
| Harold W. Moore | 1985 | Eninketene | biradikalische Cyclisierung | Phenole | [57] |
| Morgan-Walls-Reaktion | |||||
| Gilbert Thomas Morgan und Leslie Percy Walls | 1931 | N-Acyl-2-aminobiphenyl, Phosphoroxychlorid | intramolekulare Cyclisierung | Phenanthridin, Phenathridinderivate | [58] |

| |||||
| Morita-Baylis-Hillman-Reaktion | |||||
| siehe Baylis-Hillman-Reaktion | |||||
| Mori-Ban-Indolsynthese | |||||
| Miwako Mori, Yoshio Ban | 1977 | o-Halogenaniline, Palladium(II)-acetat, Triphenylphosphin | Bildung von Pd(0), oxidative Addition von Pd(0), Ringschluss, β-Hydrid-Eliminierung | Indole | [59] |
| Mori-Shibasaki-Nitrogenierung | |||||
| Miwako Mori, Masakatsu Shibaki | 1987 | Carbonsäurechloride/cyclische Carbonsäureanhydride, Titan-Magnesium-Komplex 3 THF·Mg2Cl2O·TiNCO | Insertion von Stickstoff | Amide/Imide | [60] |
| Morin-Umlagerung | |||||
| Robert Morin | 1963 | Penizillin-Sulfoxide, Säure | Umlagerung | Cephalosporine | [61] |
| Moureau-Mignonac-Ketiminsynthese | |||||
| Charles Moureau, Georges Mignonac | 1913 | Nitrile, Grignard-Verbindungen | nucleophile Addition | Ketimine | [62] |

| |||||
| Mukaiyama-Michael-Addition | |||||
| Teruaki Mukaiyama, Arthur Michael | 1973 | α,β-ungesättigte Carbonylverbindungen, Silylenolether, Lewis-Säure | Michael-Addition | Bildung einer C-C-Bindung | [63] |
| Mukaiyama-Aldolreaktion | |||||
| Teruaki Mukaiyama | 1973 | Carbonylverbindungen, silylierte Enole, Lewis-Säure | gekreuzte Aldolreaktion | β-Hydroxycarbonylverbindungen | [64] |

| |||||
| Mukaiyama-Redoxkondensation | |||||
| Teruaki Mukaiyama | 1976 | Alkohole, Triphenylphoshin, Chinone, Carbonsäuren | Kondensation | Carbonsäureester | [65] |
| Mukaiyama-Veresterung | |||||
| Teruaki Mukaiyama | 1975 | Carbonsäuren, 2-Chloro-1-methyl-pyridiniumiodid, Alkohole | Kondensation | Carbonsäureester | [66] |
| Müller-Cunradi-Pieroh-Prozess | |||||
| Martin Müller-Cunradi, Kurt Pieroh | 1939 | Acetale, Enolether, Lewis-Säure | Abspaltung eines Alkoholats, Bildung einer C-C-Bindung, Bildung eines Acetals | 3-Alkoxyacetale | [67] |

| |||||
| Müller-Rochow-Synthese | |||||
| Richard Müller, Eugene Rochow | 1940 | Chlormethan, Silicium, Kupfer | Methylchlorsilane | [68][69] | |
| Mundy-N-Acyllactam-Umlagerung | |||||
| Bradford P. Mundy | 1972 | Lactame, Carbonsäurechloride, Calciumoxid | Reaktion zum N-Acyllactam, Umlagerung in der Pyrolyse | cyclische Imine | [70] |
| Murahashi-Reaktion | |||||
| Shun‐Ichi Murahashi | 1979 | Organolithiumverbindungen, Alkenylhalogenide, Palladium-Triphenylphosphin-Katalysator | Kupplung | Alkene | [71] |

| |||||
| Murai-Reaktion | |||||
| Shinji Murai | 1993 | Aromaten, Alkene, Ruthenium-Katalysator | Bildung einer C-C-Bindung | Alkylaromaten | [72] |

| |||||
| Myers-Saito-Cyclisierung | |||||
| Andrew G. Myers, Isao Saito | 1989 | Eninallene | intramolekulare Umlagerung | Aromaten | [73][74] |

| |||||
| Myers-Alkylierung | |||||
| Andrew G. Myers | 1994 | N-acyliertes Pseudoephedrin, Lithiumdiisopropylamid, Alkyliodide | Deprotonierung in α-Position, Alkylierung | enantioselektive Carbonsäuren/Aldehyde/Alkohole | [75] |
Quellen
Bearbeiten- ↑ Donald L. MacDonald, Hermann O. L. Fischer: The Degradation of Sugars by Means of their Disulfones1. In: Journal of the American Chemical Society. 1952, Band 74, Nummer 8, S. 2087–2090 doi:10.1021/ja01128a071.
- ↑ G. P. Arsenault, E. Bullock, S. F. MacDonald: Pyrromethanes and Porphyrins Therefrom1. In: Journal of the American Chemical Society. 1960, Band 82, Nummer 16, S. 4384–4389 doi:10.1021/ja01501a066.
- ↑ W. Madelung: Über eine neue Darstellungsweise für substituierte Indole. I. In: Berichte der deutschen chemischen Gesellschaft. 45, 1912, S. 1128, doi:10.1002/cber.191204501160.
- ↑ L. C. Maillard: Formation of Melanoidins in a Methodical Way. In: Compt. Rend. 154, 1912, S. 66.
- ↑ Francis Robert Japp, William Maitland: CXLVIII.—Reduction products of αβ-dimethylanhydracetonebenzil, and condensation products of benzaldehyde with ketones. In: J. Chem. Soc., Trans.. 85, 1904, S. 1473, doi:10.1039/CT9048501473.
- ↑ George Majetich, Jean Defauw, Kenneth G. Hull, T. T. Shawe: Diastereoselectivity in intramolecular additions of allylsilanes to enones. In: Tetrahedron letters. 1985, Band 26, Nummer 39, S. 4711–4714 doi:10.1016/S0040-4039(00)94930-X.
- ↑ Mieczysław Mąkosza, Tomasz Glinka: Reaction of organic anions. Part 108. On the mechanism of the vicarious nucleophilic substitution of hydrogen in nitroarenes. In: The Journal of Organic Chemistry. 1983, Band 48, Nummer 21, S. 3860–3861 doi:10.1021/jo00169a067.
- ↑ Zbigniew Wróbel, Mieczysław Mąkosza: Synthesis of 1-hydroxyindoles and indoles from ortho-nitroarylethanes. In: Tetrahedron. 1997, Band 53, Nummer 15, S. 5501–5514 doi:10.1016/S0040-4020(97)00208-1.
- ↑ Léon Malaprade: Oxydation de quelques polyalcools par l'acides periodique. In: Comptes Rendus. 186, 1928, S. 382 (Digitalisat auf Gallica).
- ↑ C. Mannich: Eine Synthese von β-Ketonbasen. In: Archiv der Pharmazie. 255, 1917, S. 261, doi:10.1002/ardp.19172550217.
- ↑ Bogdan Marciniec: Catalytic Coupling of sp2- and sp-Hybridized Carbon–Hydrogen Bonds with Vinylmetalloid Compounds. In: Accounts of Chemical Research. 2007, Band 40, Nummer 10, S. 943–952 doi:10.1021/ar700116f.
- ↑ W. Marckwald: Ueber asymmetrische Synthese. In: Berichte der Deutschen Chemischen Gesellschaft. 1904, Band 37, Nummer 1, S. 349–354 doi:10.1002/cber.19040370165.
- ↑ István E. Markó, Kevin Lam: Using Toluates as Simple and Versatile Radical Precursors. In: Organic Letters. 2008, Band 10, Nummer 13, S. 2773–2776 doi:10.1021/ol800944p.
- ↑ C. Marschalk et al.: Bulletin de la Société Chimique de France. 1936, 3, 1545.
- ↑ James A. Marshall, Gordon L. Bundy: A New Fragmentation Reaction. The Synthesis of 1-Methyl-trans,trans-1,6-cyclodecadiene. In: Journal of the American Chemical Society. 88, 1966, S. 4291, doi:10.1021/ja00970a053.
- ↑ A. Guyot, J. Martinet: Condensation des amines aromatiques primaires et secondaires avec les éthers mésoxaliques. Syntèse dans la série de l'indole. In: Comptes rendus. 1913, 156, S. 1627 (Digitalisat auf Gallica).
- ↑ Satoru Masamune, Gordon S. Bates, John W. Corcoran: Makrolide. Neuere Fortschritte ihrer Chemie und Biochemie. In: Angewandte Chemie. 1977, Band 89, Nummer 9, S. 602–624 doi:10.1002/ange.19770890906.
- ↑ Kiyoshi Kikukawa, Tsutomu Matsuda: REACTION OF DIAZONIUM SALTS WITH TRANSITION METALS. I. ARYLATION OF OLEFINS WITH ARENEDIAZONIUM SALTS CATALYZED BY ZERO VALENT PALLADIUM. In: Chemistry Letters. 1977, Band 6, Nummer 2, S. 159–162 doi:10.1246/cl.1977.159.
- ↑ Vernon R. Mattox, Edward C. Kendall: The preparation of 3-Keto-Δ4-steroids. In: Journal of the American Chemical Society. 70, 1948, S. 882, doi:10.1021/ja01182a532.
- ↑ Vernon R. Mattox: Steroids Derived from Bile Acids. XV. The Formation of a Glyoxal Side Chain at C-17 from Steroids with Dihydroxyacetone and Δ16-Ketol Side Chains1. In: Journal of the American Chemical Society. 1952, Band 74, Nummer 17, S. 4340–4347 doi:10.1021/ja01137a029.
- ↑ Patent US2663737: Substituted phosphacyclopentene oxides and process of preparing them. Angemeldet am 7. August 1951, veröffentlicht am 22. Dezember 1953, Erfinder: W. B. McCormack.
- ↑ John S. McFadyen, Thomas S. Stevens: 128. A new method for the conversion of acids into aldehydes. In: Journal of the Chemical Society. 1936, S. 584, doi:10.1039/JR9360000584.
- ↑ F. W. McLafferty: Mass Spectrometric Analysis. Molecular Rearrangements. In: Analytical Chemistry. 31, 1959, S. 82, doi:10.1021/ac60145a015.
- ↑ John E. McMurry, Michael P. Fleming: New method for the reductive coupling of carbonyls to olefins. Synthesis of .beta.-carotene. In: Journal of the American Chemical Society. 96, 1974, S. 4708, doi:10.1021/ja00821a076.
- ↑ Keith T. Mead, Sasi K. Pillai: Carbonyl assisted intramolecular ring opening of 2-oxetanones: A stereoselective route to 2,5-disubstituted tetrahydrofurans. In: Tetrahedron Letters. 1993, Band 34, Nummer 44, S. 6997–7000 doi:10.1016/S0040-4039(00)61580-0.
- ↑ Hans Meerwein, Eberhard Büchner, Konrad van Emster: Über die Einwirkung aromatischer Diazoverbindungen auf α,β-ungesättigte Carbonylverbindungen. In: Journal für Praktische Chemie. 152, 1939, S. 237, doi:10.1002/prac.19391520705.
- ↑ Hans Meerwein, Rudolf Schmidt: Ein neues Verfahren zur Reduktion von Aldehyden und Ketonen. In: Justus Liebig's Annalen der Chemie. 444, 1925, S. 221, doi:10.1002/jlac.19254440112.
- ↑ A. Verley: The exchange of functional groups between two molecules. The passage of ketones to alcohols and the reverse. In: Bull. soc. chim. 1925, 37, S. 871-874.
- ↑ Wolfgang Ponndorf: Der reversible Austausch der Oxydationsstufen zwischen Aldehyden oder Ketonen einerseits und primären oder sekundären Alkoholen anderseits. In: Zeitschrift für Angewandte Chemie. 39, 1926, S. 138, doi:10.1002/ange.19260390504.
- ↑ Jerrold Meinwald, Santokh Singh. Labana, Mohindra Singh. Chadha: Peracid Reactions. III. The Oxidation of Bicyclo [2.2.1]heptadiene. In: Journal of the American Chemical Society. 85, 1963, S. 582, doi:10.1021/ja00888a022.
- ↑ Jakob Meisenheimer: Über eine eigenartige Umlagerung des Methyl-allyl-anilin-N-oxyds. In: Berichte der deutschen chemischen Gesellschaft. 52, 1919, S. 1667, doi:10.1002/cber.19190520830.
- ↑ J. B. Menke: Nitrieren mit Nitraten. In: Recueil des Travaux Chimiques des Pays-Bas. 44, 1925, S. 141, doi:10.1002/recl.19250440209.
- ↑ N. Menschutkin: Beiträge zur Kenntnis der Affinitätskoeffizienten der Alkylhaloide und der organischen Amine. In: Zeitschrift für Physikalische Chemie. 5U, 1890, doi:10.1515/zpch-1890-0546.
- ↑ Darius Molho, Charles Mentzer: Sur la bromuration des coumarines au moyen de la N-Bromsuccinimide. In: Comptes Rendus. 223, 1946, S. 1141 (Digitalisat auf Gallica).
- ↑ R. B. Merrifield: Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide. In: Journal of the American Chemical Society. 85, 1963, S. 2149, doi:10.1021/ja00897a025.
- ↑ O. Meth-Cohn, Bramha Narine: A versatile new synthesis of quinolines, thienopyridines and related fused pyridines. In: Tetrahedron Letters. 19, 1978, S. 2045, doi:10.1016/S0040-4039(01)94745-8.
- ↑ G. Meyer: Ueber einige anomale Reaktionen. In: Berichte der deutschen chemischen Gesellschaft. 16, 1883, S. 1439, doi:10.1002/cber.188301601316.
- ↑ Christoph Hartmann, Victor Meyer: Ueber die Jodoniumbasen. In: Berichte der deutschen chemischen Gesellschaft. 27, 1894, S. 502, doi:10.1002/cber.18940270199.
- ↑ A. I. Meyers, Gerald Knaus, K. Kamata: Synthesis via 2-oxazolines. IV. Asymmetric synthesis of 2-methylalkanoic acids from a chiral oxazoline. In: Journal of the American Chemical Society. 96, 1974, S. 268, doi:10.1021/ja00808a054.
- ↑ Albert I. Meyers, Aiko Nabeya, H. Wayne Adickes, Ieva R. Politzer: Aldehydes from dihydro-1,3-oxazines. I. Synthesis of aliphatic aldehydes and their C-1 deuterated derivatives. In: Journal of the American Chemical Society. 91, 1969, S. 763, doi:10.1021/ja01031a053.
- ↑ A. I. Meyers, Gregory P. Brengel: Chiral bicyclic lactams: useful precursors and templates for asymmetric syntheses. In: Chemical Communications. 1997, Nummer 1, S. 1–8 doi:10.1039/A604443C.
- ↑ Kurt H. Meyer, Kurt Schuster: Umlagerung tertiärer Äthinyl-carbinole in ungesättigte Ketone. In: Berichte der deutschen chemischen Gesellschaft. 55, 1922, S. 819, doi:10.1002/cber.19220550403.
- ↑ A. Michael: Ueber die Addition von Natriumacetessig- und Natriummalonsäureäthern zu den Aethern ungesättigter Säuren. In: Journal für Praktische Chemie. 35, 1887, S. 349, doi:10.1002/prac.18870350136.
- ↑ A. Michaelis, Thomas Becker: Ueber die Constitution der phosphorigen Säure. In: Berichte der Deutschen Chemischen Gesellschaft. 1897, Band 30, Nummer 1, S. 1003–1009 doi:10.1002/cber.189703001193.
- ↑ M. Mark Midland, Alfonso Tramontano, Stephen A. Zderic: Preparation of optically active benzyl-.alpha.-d alcohol via reduction by B-3.alpha.-pinanyl-9-borabicyclo[3.3.1]nonane. A new highly effective chiral reducing agent. In: Journal of the American Chemical Society. 99, 1977, S. 5211, doi:10.1021/ja00457a068.
- ↑ Ch. Meystre, H. Frey, A. Wettstein, K. Miescher: Über Steroide. (39. Mitteilung). Ein einfacher Abbau der Gallensäuren-Seitenkette zur Methylketonstufe. In: Helvetica Chimica Acta. 27, 1944, S. 1815, doi:10.1002/hlca.194402701230.
- ↑ Georges Mignonac: Nouvelle méthode générale de préparation des amines à partir des aldéhydes ou des cétones. In: Compt. Rend. 1921, 172, S. 223–226 (Digitalisat auf Gallica).
- ↑ Nicholas A. Milas, Sidney Sussman: The Hydroxylation of the Double Bond. In: Journal of the American Chemical Society. 58, 1936, S. 1302, doi:10.1021/ja01298a065.
- ↑ F. Minisci, R. Bernardi, F. Bertini, R. Galli, M. Perchinummo: Nucleophilic character of alkyl radicals—VI. In: Tetrahedron. 27, 1971, S. 3575, doi:10.1016/S0040-4020(01)97768-3.
- ↑ Reginald Tang, Kurt Mislow: Rates and equilibria in the interconversion of allylic sulfoxides and sulfenates. In: Journal of the American Chemical Society. 92, 1970, S. 2100, doi:10.1021/ja00710a051.
- ↑ D. A. Evans, G. C. Andrews, C. L. Sims: Reversible 1,3 transposition of sulfoxide and alcohol functions. Potential synthetic utility. In: Journal of the American Chemical Society. 93, 1971, S. 4956, doi:10.1021/ja00748a075.
- ↑ Oyo Mitsunobu, Masaaki Yamada: Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts. In: Bulletin of the Chemical Society of Japan. 40, 1967, S. 2380, doi:10.1246/bcsj.40.2380.
- ↑ Noemı́ Garcı́a-Delgado, Antoni Riéra, Xavier Verdaguer: Phosphine-Dependent Stereoselectivity in the Mitsunobu Cyclodehydration of 1,2-Diols: Stereodivergent Approach to Triaryl-Substituted Epoxides. In: Organic Letters. 2007, Band 9, Nummer 4, S. 635–638 doi:10.1021/ol0629420.
- ↑ Tatsuo Ishiyama, Miki Murata, Norio Miyaura: Palladium(0)-Catalyzed Cross-Coupling Reaction of Alkoxydiboron with Haloarenes: A Direct Procedure for Arylboronic Esters. In: The Journal of Organic Chemistry. 60, 1995, S. 7508, doi:10.1021/jo00128a024.
- ↑ I. I. Moiseev, M. N. Vargaftik, Ya. K. Syrkin: On the mechanism of the reaction of palladium salts with olefines in hydroxyl-containing solutions. In: Dokl. Akad. Nauk SSSR. 133:2, 1960, S 377–380 (online).
- ↑ Eric Oblinger, John Montgomery: A New Stereoselective Method for the Preparation of Allylic Alcohols. In: Journal of the American Chemical Society. 119, 1997, S. 9065, doi:10.1021/ja9719182.
- ↑ J. Olle Karlsson, . Nghi V. Nguyen, Lafayette D. Foland, Harold W. Moore: (2-Alkynylethenyl)ketenes. A new quinone synthesis. In: Journal of the American Chemical Society. 107, 1985, S. 3392, doi:10.1021/ja00297a081.
- ↑ Gilbert Thomas Morgan, Leslie Percy Walls: CCCXXXV.—Researches in the phenanthridine series. Part I. A new synthesis of phenanthridine homologues and derivatives. In: Journal of the Chemical Society. 1931, S. 2447–2456, doi:10.1039/JR9310002447.
- ↑ Miwako Mori, Katsumi Chiba, Yoshio Ban: The reactions and syntheses with organometallic compounds. V. a new synthesis of indoles and isoquinolines by intramolecular palladium-catalyzed reactions of aryl halides with olefinic bonds. In: Tetrahedron Letters. 18, 1977, S. 1037, doi:10.1016/S0040-4039(01)92822-9.
- ↑ Miwako Mori, Yasuhiro Uozumi, Masakatsu Shibaki: Incorporation of molecular nitrogen into amides and imides by use of titanium nitrogen complexes. In: Tetrahedron Letters. 1987, Band 28, Nummer 49, S. 6187–6190 doi:10.1016/S0040-4039(00)61842-7.
- ↑ Robert B. Morin, Bill G. Jackson, Richard A. Mueller, E. R. Lavagnino, William B. Scanlon, Sandra L. Andrews: Chemistry of Cephalosporin Antibiotics. III. Chemical Correlation of Penicillin and Cephalosporin Antibiotics. In: Journal of the American Chemical Society. 85, 1963, S. 1896, doi:10.1021/ja00895a063.
- ↑ Charles Moureau, Georges Mignonac: Les cétimines. In: Comptes Rendus. 156, 1913, S. 1801 (Digitalisat auf Gallica).
- ↑ Teruaki Mukaiyama, Koichi Narasaka, Kazuo Banno: New aldol type reaction. In: Chemistry Letters. 2, 1973, S. 1011, doi:10.1246/cl.1973.1011.
- ↑ Teruaki Mukaiyama, Koichi Narasaka, Kazuo Banno: NEW ALDOL TYPE REACTION. In: Chemistry Letters. 2, 1973, S. 1011, doi:10.1246/cl.1973.1011.
- ↑ Teruaki Mukaiyama: Die Oxidations‐Reduktions‐Kondensation. In: Angewandte Chemie. 1976, Band 88, Nummer 4, S. 111–120 doi:10.1002/ange.19760880403.
- ↑ Teruaki Mukaiyama, Masahiro Usui, Eiichiro Shimada, Kazuhiko Saigo: A CONVENIENT METHOD FOR THE SYNTHESIS OF CARBOXYLIC ESTERS. In: Chemistry letters. 1975, Band 4, Nummer 10, S. 1045–1048 doi:10.1246/cl.1975.1045.
- ↑ Patent US2165962: Production of alkylidene diethers or ether-esters. Angemeldet am 22. Oktober 1937, veröffentlicht am 11. Juli 1939, Anmelder: I.G. Farbenindustrie Aktiengesellschaft, Erfinder: Martin Mueller-Cunradi, Kurt Pieroh.
- ↑ Patent US2380995A: Preparation of organosilicon halides. Angemeldet am 26. September 1941, veröffentlicht am 7. August 1945, Anmelder: General Electric Co, Erfinder: Eugene G Rochow.
- ↑ Patent DEC57411: Erfinder: Richard Müller.
- ↑ Bradford P. Mundy, Brent Larsen, Lee F. McKenzie, G. A. Braden: Convenient synthesis of myosmine. In: Journal of organic chemistry. 1972, Band 37, Nummer 10, S. 1635–1636 doi:10.1021/jo00975a038.
- ↑ Shun‐Ichi Murahashi, Masaaki Yamamura, Kenichi Yanagisawa, Nobuaki Mita, Kaoru Kondo: Stereoselective synthesis of alkenes and alkenyl sulfides from alkenyl halides using palladium and ruthenium catalysts. In: The Journal of Organic Chemistry. 1979, Band 44, Nummer 14, S. 2408–2417 doi:10.1021/jo01328a016.
- ↑ Shinji Murai, Fumitoshi Kakiuchi, Shinya Sekine, Yasuo Tanaka, Asayuki Kamatani, Motohiro Sonoda, Naoto Chatani: Efficient catalytic addition of aromatic carbon-hydrogen bonds to olefins. In: Nature. 366, 1993, S. 529-531, doi:10.1038/366529a0.
- ↑ Andrew G. Myers, Elaine Y. Kuo, Nathaniel S. Finney: Thermal generation of .alpha.,3-dehydrotoluene from (Z)-1,2,4-heptatrien-6-yne. In: Journal of the American Chemical Society. 111, 1989, S. 8057, doi:10.1021/ja00202a079.
- ↑ Ryu Nagata, Hidenori Yamanaka, Eiichi Okazaki, Isao Saito: Biradical formation from acyclic conjugated eneyne-allene system related to neocarzinostatin and esperamicin-calichemicin. In: Tetrahedron Letters. 30, 1989, S. 4995, doi:10.1016/S0040-4039(01)80564-5.
- ↑ Andrew G. Myers, Bryant H. Yang, Hou Chen, James L. Gleason: Use of Pseudoephedrine as a Practical Chiral Auxiliary for Asymmetric Synthesis. In: Journal of the American Chemical Society. 116, 1994, S. 9361, doi:10.1021/ja00099a076.
