| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Kabachnik-Fields-Reaktion | |||||
| Martin Israilewitsch Kabachnik, Ellis K. Fields | 1952 | Aldehyde, Amine, Phosphonsäure | Mehrkomponentenreaktion | α-Aminophosphonate | [1][2] |

| |||||
| Kabbe-Chromanonsynthese | |||||
| Hans-Joachim Kabbe | 1976 | Salicylaldehyde/o-Hydroxyarylketone, Enamine/Ketone | Kondensation | Chromanone | [3] |

| |||||
| Kagan-Molander-Kupplung | |||||
| Henri Kagan, Gary Molander | 1980/84 | Alkylhalogenide, Ketone/Aldehyde, Samarium(II)-iodid | Kupplung | Alkohole | [4][5] |

| |||||
| Kagan-Modena-Oxidation | |||||
| Henri Kagan, Giorgio Modena | 1984 | Sulfide, tert-Butylhydroperoxid, Titan-Komplex | assymetrische Oxidation | chirale Sulfoxide | [6][7] |

| |||||
| Kahne-Glycosidierung | |||||
| Daniel Kahne | 1989 | Glycosyl-Sulfoxide, Trifluormethansulfonsäureanhydrid, Nuleophil | Einführung der Triflylgruppe, Ersetzung der Gruppe durch das Nucleophil | stereoselektive O-, S- oder N-Glycoside | [8] |
| Kaiser-Johnson-Middleton-Reaktion | |||||
| Donald W. Kaiser, Francis Johnson, William Middleton | 1953/58/62 | Dinitrile, Bromwasserstoff | Cyclisierung | N-Heterocyclen | [9][10][11] |
| Kaluza-Reaktion | |||||
| Ludwig Kaluza | 1912 | Amine, Kohlenstoffdisulfid | Bildung eines Thiocarbamates | Isothiocyanate | [12] |
| Kametani-Oxidation | |||||
| Tetsuji Kametani | 1977 | Amine, Sauerstoff, Kupfer(I)-chlorid/Pyridin | oxidativer Abbau | Nitrile | [13] |
| Kamlet-Reaktion | |||||
| siehe Henry-Reaktion | |||||
| Katritzky-Pyridinsynthese | |||||
| Alan Katritzky | 1999 | α-substituierte Ketone, α,β-ungesättigte Carbonylverbindungen, Ammoniumacetat | Michael-Addition, Eliminierung | Pyridine | [14] |
| Katritzky-Reaktion | |||||
| Alan Katritzky | 1979 | Amine, Pyryliumsalze | Bildung eines Pyridiniumsalzes, nucleophile Substitution | [15] | |
| Keck-Macrolactonisierung | |||||
| Gary E. Keck | 1985 | ω-Hydroxycarbonsäuren, Dicyclohexylcarbodiimid, 4-(Dimethylamino)pyridin, DMAP-HCl | Aktivierung, Steglich-Veresterung | Makrolactone | [16] |
| Kauffmann-Cycloaddition | |||||
| Thomas Kauffmann | 1972 | Azallylanionen, Alkene | stereoselektive [3+2]-Cycloaddition | Pyrrolidine | [17] |
| Kauffmann-Dimerisierung | |||||
| Thomas Kauffmann | 1967 | Heteroaromaten/aromatische Nitrile, Kupfer(I)-salze, Magnesium- oder Lithiumaromatische Verbindungen | Dimerisierung | Ketazine/Polyheteroaromaten | [18] |
| radikalische Keck-Allylierung | |||||
| Gary E. Keck | 1982 | Alkylhalogenide, Allyltributylstannan, AIBN | radikalische Substitution | Allylalkane | [19] |
| asymmetrische Keck-Allylierung | |||||
| Gary E. Keck | 1993 | Aldehyde, Allylstannane, BINOL, Titantetraisopropylat | Addition | enantioselektive Allylalkohole | [20] |
| Kemp-Eliminierung | |||||
| Daniel S. Kemp | 1973 | Benzisoxazole, Base | Ringöffnung | α-Nitrilophenole | [21] |

| |||||
| Kemp-Decarboxylierung | |||||
| Daniel S. Kemp | 1973 | Benzisoxazole mit Carboxygruppe am C3, Base | Ringöffnung mit Decarboxylierung | α-Nitrilophenole | [21] |
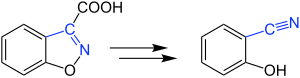
| |||||
| Kendall-Mattox-Reaktion | |||||
| Edward Calvin Kendall, Vernon R. Mattox | 1948 | α-Bromketone, Phenylhydrazin, 2-Oxopropanoat | α,β-ungesättigte Ketone | [22] | |

| |||||
| Kennedys oxidative Cyclisierung | |||||
| Robert M. Kennedy | 1992 | 5-Hdroxyalkene, Rhenium(VII)-oxid | stereoselektive Cyclisierung | trans-Tetrahydrofurane | [23] |
| Kharasch-Addition | |||||
| Morris S. Kharasch | 1945 | Tetrahalogenmethane, terminale Alkene, Peroxid | radikalische Addition | Halogenalkane | [24] |

| |||||
| Kharasch-Sosnovsky-Reaktion | |||||
| Morris S. Kharasch, George Sosnovsky | 1958 | Alkene, Peroxyester, Kupfer(I)-Salz | radikalische Oxidation in Allylposition | Allylbezoate/-alkohole | [25] |

| |||||
| Kiliani-Fischer-Synthese | |||||
| Heinrich Kiliani, Emil Fischer | 1885 | Monosaccharide, Blausäure, Wasser, Natriumamalgam | nucleophile Addition, Hydrolyse, Reduktion | verlängerte Monosaccaride | [26][27] |
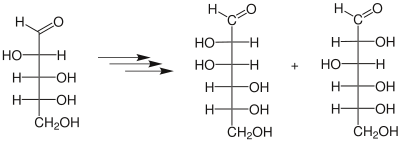
| |||||
| Kinugasa-Reaktion | |||||
| Manabu Kinugasa | 1972 | Nitrone, terminale Alkine, Kupfer(I)-Salze | Bildung eines Acetylides, [1,3]-dipolare Cycloaddition, Umlagerung | β-Lactame | [28] |

| |||||
| Kishner-Cyclopropansynthese (Kishner-Abbau) | |||||
| Nikolai Kischner | 1911 | α,β-ungesättigte Ketone, Hydrazin | Bildung eines Pyrazolines, Zersetzung | Cyclopropane | [29] |
| Klemer-Rodemeyer-Reaktion | |||||
| Almuth Klemer, Günther Rodemeyer | 1975 | Benzyliden-geschützte Monosaccharide, Butyllithium | Cycloeliminierung | Ketosen | [30] |
| Knochel-Vinylkupplung | |||||
| Paul Knochel | 1988 | Vinylhalogenide, Alkyl/Aryliodide, Zink, Kupfercyanid | Bildung eines Knochel-Cuprates, Kupplung | Bildung einer C-C-Bindung | [31] |
| Knölker-Carbazol-Synthese | |||||
| Hans-Joachim Knölker | 1989 | Cyclohexadientricarbonyleisen-Halbsandwichkomplexe, aromatische Amine, Oxidationsmittel | Kupplung, oxidative Cyclisierung | Carbazole | [32] |
| Knoevenagel-Reaktion | |||||
| Emil Knoevenagel | 1898 | Ketone/Aldehyde, CH-acide Verbindungen, Base | Deprotonierung, nucleophiler Angriff, Kondensation | Bildung einer C-C-Doppelbindung | [33] |

| |||||
| Knoevenagel-Diazotierung | |||||
| Emil Knoevenagel | 1890 | primäre Amine, Amylnitrit | Diazotierung | Diazoniumsalze | [34] |
| Knoop-Oesterlin-Aminosäuresynthese | |||||
| Franz Knoop, Hubert Oesterlin | 1925 | α-Ketosäuren, Ammoniak, Wasserstoff/Palladium | katalytische Hydrierung | α-Aminosäuren | [35] |

| |||||
| Knorr-Chinolinsynthese | |||||
| Ludwig Knorr | 1886 | Anilin, β-Ketoester, Säure | Cyclisierung unter Abspaltung von Wassser und Methanol | Chinoline | [36] |
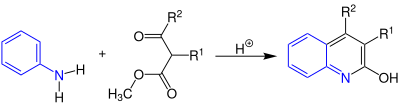
| |||||
| Knorr-Pyrazolsynthese | |||||
| Ludwig Knorr | 1883 | 1,3-Dicarbonnylverbindungen, Hydrazine | Kondensation | Pyrazole | [37] |

| |||||
| Knorr-Pyrrolsynthese | |||||
| Ludwig Knorr | 1885 | α-Aminoketone, β-Ketoester | Cyclisierung | Pyrrole | [38] |

| |||||
| Kobayashi-Aldolreaktion | |||||
| Susumu Kobayashi | 2004 | chirale Vinylketensilyl-N,O-acetale, Aldehyde | stereoselektive vinyloge Mukaiyama-Aldolreaktion | Polyketide | [39] |
| Koch-Haaf-Carbonylierung (Koch-Reaktion) | |||||
| Herbert Koch, Wolfgang Haaf | 1958 | Alkene, Kohlenstoffmonoxid, Säure | Protonierung, nucleophiler Angriff des CO, Hydrolyse | Koch-Säuren | [40] |

| |||||
| Kocheshkov-Umlagerung | |||||
| Xenofont Alexandrowitsch Kotscheschkow | 1929 | Zinn(IV)-halogenide, Zinntetraalkyl/arylverbindungen | Komproportionierung | Zinnhalogenalkyl/arylverbindungegn | [41] |
| Kochi-Kupplung | |||||
| Jay K. Kochi | 1975 | Alkenylhalogenide, Grignard-Verbindungen, Eisen-Verbindungen (Katalysator) | Kreuzkupplung | Alkene | [42] |
| Kochi-Reaktion | |||||
| Jay K. Kochi | 1965 | Carbonsäuren, Blei(IV)-acetat, Lithiumchlorid | oxidative Decarboxylierung | Halogenkohlenwasserstoffe | [43] |

| |||||
| Koenigs-Knorr-Methode | |||||
| Wilhelm Koenigs, Eduard Knorr | 1901 | Monosacccharid-halogenide, Silber(I)-carbonat, Methanol | Abspaltung des Halogenides, Nucleophile Substitution | Glycoside | [44] |

| |||||
| Kohler-Synthese | |||||
| Elmer Peter Kohler | 1924 | 1,3-Dinitroalkane, Natriummethanolat | Cyclisierung | Isoxazol-N-oxide | [45] |
| Kolbe-Elektrolyse | |||||
| Hermann Kolbe | 1848 | Carbonsäuren, elektrischer Strom | elektrolytische, radikalische Oxidation, CO2-Abspaltung, Dimerisierung | Alkane | [46] |

| |||||
| Kolbe-Nitrilsynthese | |||||
| benannt nach Hermann Kolbe | Alkylhalogenide, Alkalicyanide | nucleophile Substitution | Alkylnitrile | ||

| |||||
| Kolbe-Schmitt-Reaktion | |||||
| Herrmann Kolbe, Rudolf Schmitt | 1860/84 | Phenole, Natrium/Kalium, Kohlenstoffdioxid | Deprotonierung, elektrophile Substitution | o- oder p-Hydroxybenzoesäure | [47][48] |

| |||||
| Kölbel-Engelhardt-Synthese | |||||
| Herbert Kölbel, Friedrich Engelhardt | 1955 | Kohlenstoffmonoxid, Wasser, Katalysator | Weiterentwicklung der Fischer-Tropsch-Synthese | synthetische Kraftstoffe | [49] |
| Kondakow-Reaktion | |||||
| Iwan Kondakow | 1893 | Alkene, Carbonsäurehalogenide, Lewis-Säure | Acylierung | β-Halogenketone | [50] |

| |||||
| Kondrat’eva-Pyridinsynthese | |||||
| G. Y. Kondrat'eva | 1957 | Oxazol, Alkene | Diels-Alder-Reaktion | Pyridine | [51] |

| |||||
| Kornblum-Oxidation | |||||
| Nathan Kornblum | 1957 | Alkylhalogenide, Dimethylsulfoxid, Triethylamin | Oxidation | Aldehyde | [52] |

| |||||
| Kornblum-DeLaMare-Umlagerung | |||||
| Nathan Kornblum, Harold E. DeLaMare | 1951 | organische Peroxide, Base | Umlagerung | Ketone und Alkohole | [53] |
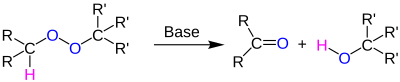
| |||||
| Kornfeld-Boger-Ringverengung | |||||
| Edmund Kornfeld, Dale Boger | 1980/2005 | konjugierte Alkene/Alkine, 1,2,4,5-Tetrazine, Zink | Diels-Alder-Reaktion, Reduktion | Pyrrole | [54][55] |
| Körner-Contardi-Reaktion | |||||
| G. Körner, A. Contrardi | 1914 | Aryldiazoniumverbindungen, Kupfersulfat, Brom-/Chlorwasserstoff | Sandmeyer-Reaktion | Halogenaromaten | [56] |
| Kostanecki-Reaktion (Kostanecki-Robinson-Reaktion) | |||||
| Stanislaus von Kostanecki | 1901 | ortho-Hydroxyacetophenone, aliphatische Carbonsäureanhydride | Acylierung, Aldolkondensation | Cumarin, Chromone | [57] |

| |||||
| Köster-Verfahren | |||||
| Roland Köster | 1960 | Alkene, Aluminium, Wasserstoff, Bortrioxid | Transmetallierung | Alkylborverbindungen | [58] |
| Kowalski-Ester-Homologierung | |||||
| Conrad J. Kowalski | 1985 | Carbonsäureester, Dibrommethyllithium, starke Base | Carbonsäureester mit um ein Glied verlängerter Kette | [59] | |

| |||||
| Krafft-Abbau | |||||
| Friedrich Krafft | 1879 | Erdalkalisalze von Carbonsäuren, entsprechende Acetate, Chrom(VI)-oxid | trockene Destillation zum Methylketon, Oxidation | verkürzte Carbonsäuren | [60] |

| |||||
| Krapcho-Reaktion | |||||
| Andrew Paul Krapcho | 1967 | α-monosubstituierte oder α,α-disubstituierte Ester, Kaliumcyanid | Decarboxylierung | Ersetzen der Estergruppe durch H-Atom | [61] |
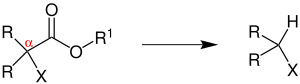
| |||||
| Kresze-Aminierung (Sharpless-Kresze-Aminierung) | |||||
| Günter Kresze | 1975 | Alkene, Schwefeldiimide, Base | [3+2]-sigmatrope Umlagerung, basische Aufarbeitung | Allylamine | [62] |
| Kriewitz-Kondensation | |||||
| Oscar Kriewitz | 1899 | Olefine, Formaldehyd | Kondensation | ungesättigte primäre Alkohole | [63] |

| |||||
| Krische-Allylierung | |||||
| Michael J. Krische | 2008 | Aldehyde/Alkohole, Allylverbindungen, chiraler Rh/Ir/Ru-Katalysator, Wasserstoff | reduktive Kupplung | sekundäre Homoallylalkohole | [64] |
| Kröhnke-Aldehydsynthese | |||||
| Fritz Kröhnke | 1936 | Arylmethylhalogenide, Pyridin, N,N-Dimethyl-4-nitrosoanilin | Bildung eines Nitrons, Hydrolyse | Aldehyde | [65] |
| Kröhnke-Pyridinsynthese | |||||
| Fritz Kröhnke | 1961 | Pyridin, α,β-ungesättigte Ketone | Synthese von Pyridinderivaten | Pyridinderivate | [66] |

| |||||
| Kutscherov-Reaktion | |||||
| Michail Kutscherow | 1881 | Alkine, Quecksilber(II)-sulfat, Säure | Hydratisierung | Aldehyde/Ketone | [67] |

| |||||
| Kuhn-Roth-Oxidation | |||||
| Richard Kuhn, Hubert Roth | 1933 | organische Moleküle, Chromsäure, Schwefelsäure | Oxidation zu Essigsäure | Bestimmung der Anzahl Methylgruppen in einem Molekül | [68] |
| Kuhn-Winterstein-Reaktion | |||||
| Richard Kuhn, Alfred Winterstein | 1928 | 1,2-Glycole, Diphosphotetraiodid | Reduktion | trans-Alkene | [69] |
| Kulinkovich-Reaktion | |||||
| Oleg Kulinkovich | 1989 | Carbonsäureester, Grignard-Verbindungen, Titan(IV)-alkoholat (Katalysator) | Transmetallierungen | Cyclopropanole | [70] |
| Kumada-Kupplung | |||||
| Makoto Kumada | 1972 | Alkenyl- oder Arylhalogenide, Grignard-Verbindungen, Nickel-Komplex (Katalysator) | Kupplung | Bildung einer C-C-Bindung | [71] |

| |||||
| Kuwajima-Urabe-Synthese | |||||
| Isao Kuwajima, Hirokazu Urabe | 1982 | Silylenolether, Aryl/Alkenylbromide, Palladium und Zinnverbindungen (Katalysator) | Kupplung | α-Aryl(alkenyl)ketone | [72] |
| Kyodai-Nitrierung | |||||
| Hitomi Suzuki (benannt nach der Universität Kyōto) | 1991 | Aromaten, Stickoxide, Ozon | elektrophile aromatische Substitution | Nitroaromaten | [73] |
Quellen
Bearbeiten- ↑ Martin I. Kabachnik, T. Ya. Medved: Новый метод синтеза сс-аминофосфиновых кислот (A new method for the synthesis of α-amino phosphoric acids). In: Doklady Akademii Nauk SSSR. 83, 1952, S. 689.
- ↑ Ellis K. Fields: The Synthesis of Esters of Substituted Amino Phosphonic Acids. In: Journal of the American Chemical Society. 74, 1952, S. 1528, doi:10.1021/ja01126a054.
- ↑ Hans‐Joachim Kabbe, Helmut Heitzer: 1,2‐Dihydro‐3H‐xanthene aus Salicylaldehyden und Enaminen. In: Justus Liebig s Annalen der Chemie. 1976, Band 1976, Nummer 3, S. 511–518 doi:10.1002/jlac.197619760316.
- ↑ P. Girard, J. L. Namy, H. B. Kagan: Divalent lanthanide derivatives in organic synthesis. 1. Mild preparation of samarium iodide and ytterbium iodide and their use as reducing or coupling agents. In: Journal of the American Chemical Society. 102, 1980, S. 2693, doi:10.1021/ja00528a029.
- ↑ Gary A. Molander, Jeffrey B. Etter: Lanthanides in organic synthesis. Synthesis of bicyclicalcohols. In: Tetrahedron Letters. 25, 1984, S. 3281, doi:10.1016/S0040-4039(01)81364-2.
- ↑ Philippe Pitchen, Henri B. Kagan: An efficient asymmetric oxidation of sulfides to sulfoxides. In: Tetrahedron letters. 1984, Band 25, Nummer 10, S. 1049–1052 doi:10.1016/S0040-4039(01)80097-6.
- ↑ Fulvio Di Furia, G. Modena, Roberta Seraglia: Synthesis of Chiral Sulfoxides by Metal-Catalyzed Oxidation witht-Butyl Hydroperoxide. In: Synthesis. 1984, Band 1984, Nummer 04, S. 325–326 doi:10.1055/s-1984-30829.
- ↑ Daniel Kahne, Suzanne Walker, Yuan Cheng, Donna Van Engen: Glycosylation of unreactive substrates. In: Journal of the American Chemical Society. 111, 1989, S. 6881, doi:10.1021/ja00199a081.
- ↑ Patent US2630433: Formoguaminine and their preparation. Veröffentlicht am 3. März 1953, Erfinder: Donald W. Kaiser, John J. Roemer.
- ↑ Francis Johnson, J. P. Panella, A. A. Carlson, D. H. Hunneman: Polyfunctional Aliphatic Compounds. II.1 The Cyclization of Dinitriles by Anhydrous Halogen Acids. Pyridines. In: The Journal of Organic Chemistry. 1962, Band 27, Nummer 7, S. 2473–2478 doi:10.1021/jo01054a044.
- ↑ William J. Middleton, V. A. Engelhardt, B. S. Fisher: Cyanocarbon Chemistry. VIII.1 Heterocyclic Compounds from Tetracyanoethylene. In: Journal of the American Chemical Society. 1958, Band 80, Nummer 11, S. 2822–2829 doi:10.1021/ja01544a058.
- ↑ Ludwig Kaluza: Über eine neue Darstellungsmethode von Senfölen. In: Monatshefte für Chemie. 1912, Band 33, Nummer 4, S. 363–371 doi:10.1007/BF01517943.
- ↑ Tetsuji Kametani, Keiichi Takahashi, Tatsushi Ohsawa, Masataka Ihara: Oxidation of Amines to Nitriles or Aldehydes using Copper(I) Chloride. In: Synthesis. 1977, Band 1977, Nummer 04, S. 245 doi:10.1055/s-1977-24333.
- ↑ Alan R. Katritzky: A Novel and Efficient 2,4,6-Trisubstituted Pyridine Ring Synthesis via α-Benzotriazolyl Ketones. In: Synthesis. 1999, Band 1999, Nummer 12, S. 2114–2118 doi:10.1055/s-1999-3637.
- ↑ Alan R. Katritzky, Urban Gruntz, David H. Kenny, Marcos Caroli Rezende, Hamid Sheikh: Heterocycles in organic synthesis. Part 10. Conversion of amines into esters. In: Journal of the Chemical Society. Perkin transactions I/Journal of the Chemical Society. Perkin transactions. I. 1979, S. 430 doi:10.1039/P19790000430.
- ↑ Eugene P. Boden, Gary E. Keck: Proton-transfer steps in Steglich esterification: a very practical new method for macrolactonization. In: The Journal of Organic Chemistry. 50, 1985, S. 2394, doi:10.1021/jo00213a044.
- ↑ Thomas Kauffmann, Edgar Köppelmann: Stereochemie der Cycloaddition von 1,3‐Diphenyl‐2‐azallyllithium an Alkene bei 0°C. In: Angewandte Chemie. 1972, Band 84, Nummer 6, S. 261–262 doi:10.1002/ange.19720840608.
- ↑ Th. Kauffmann, Jacob Albrecht, Dieter Berger, J. Legler: „Dimerisierung” organischer Stickstoffverbindungen über kupferhaltige Zwischenstufen. In: Angewandte Chemie. 1967, Band 79, Nummer 13, S. 620 doi:10.1002/ange.19670791310.
- ↑ Gary E. Keck, John B. Yates: Carbon-carbon bond formation via the reaction of trialkylallylstannanes with organic halides. In: Journal of the American Chemical Society. 104, 1982, S. 5829, doi:10.1021/ja00385a066.
- ↑ Gary E. Keck, Kenneth H. Tarbet, Leo S. Geraci: Catalytic asymmetric allylation of aldehydes. In: Journal of the American Chemical Society. 115, 1993, S. 8467, doi:10.1021/ja00071a074.
- ↑ a b D. S. Kemp, Martha L. Casey: Physical organic chemistry of benzisoxazoles. II. Linearity of the Broensted free energy relation for the base-catalyzed decomposition of benzisoxazoles. In: Journal of the American Chemical Society. 95, 1973, S. 6670, doi:10.1021/ja00801a024.
- ↑ Vernon R. Mattox, Edward C. Kendall: The preparation of 3-Keto-Δ4-steroids. In: Journal of the American Chemical Society. 70, 1948, S. 882, doi:10.1021/ja01182a532.
- ↑ Robert M. Kennedy, Suhan Tang: Directed oxidative cyclization of 5-hydroxyalkenes with rhenium oxide. In: Tetrahedron letters. 1992, Band 33, Nummer 26, S. 3729–3732 doi:10.1016/0040-4039(92)80010-H.
- ↑ M. S. Kharasch, Elwood V. Jensen, W. H. Urry: Addition of Carbon Tetrachloride and Chloroform to Olefins. In: Science. 1945, Band 102, Nummer 2640, S. 128 doi:10.1126/science.102.2640.128.a.
- ↑ M. S. Kharasch, George Sosnovsky: THE REACTIONS OF t-BUTYL PERBENZOATE AND OLEFINS—A STEREOSPECIFIC REACTION1. In: Journal of the American Chemical Society. 1958, Band 80, Nummer 3, S. 756 doi:10.1021/ja01536a062.
- ↑ Heinrich Kiliani: Ueber das Cyanhydrin der Lävulose. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 3066, doi:10.1002/cber.188501802249.
- ↑ Emil Fischer: Reduction von Säuren der Zuckergruppe. In: Berichte der deutschen chemischen Gesellschaft. 22, 1889, S. 2204, doi:10.1002/cber.18890220291.
- ↑ Manabu Kinugasa, Shizunobu Hashimoto: The reactions of copper(I) phenylacetylide with nitrones. In: Journal of the Chemical Society. Chemical communications. 1972, Nummer 8, S. 466 doi:10.1039/C39720000466.
- ↑ N. M. Kishner, A. Zavadovskii: In: J. Russ. Phys. Chem. Soc. 43, 1911, S. 1132.
- ↑ Almuth Klemer, Günther Rodemeyer: Eine neuartige Eliminierungsreaktion an Kohlenhydraten Synthese des Methyl‐4,6‐O‐benzyliden‐3‐desoxy‐2‐O‐methyl‐α‐D‐erythro‐hex‐2‐enopyranosids. In: Chemische Berichte. 1975, Band 108, Nummer 6, S. 1896–1901 doi:10.1002/cber.19751080612.
- ↑ Paul Knochel, M.-C.P. Yeh, Scott C. Berk, Jason Talbert: Synthesis and reactivity toward acyl chlorides and enones of the new highly functionalized copper reagents RCu(CN)ZnI. In: Journal of organic chemistry. 1988, Band 53, Nummer 10, S. 2390–2392 doi:10.1021/jo00245a057.
- ↑ Hans‐Joachim Knölker, Michael Bauermeister, Dieter Bläser, Roland Boese, Jörn‐Bernd Pannek: Hochselektive Oxidationen von Fe(CO)3‐Cyclohexadien‐Komplexen: Synthese von 4b,8a‐Dihydrocarbazol‐3‐onen und erste Totalsynthese von Carbazomycin A. In: Angewandte Chemie. 1989, Band 101, Nummer 2, S. 225–227 doi:10.1002/ange.19891010234.
- ↑ E. Knoevenagel: Condensation von Malonsäure mit aromatischen Aldehyden durch Ammoniak und Amine. In: Berichte der deutschen chemischen Gesellschaft. 31, 1898, S. 2596, doi:10.1002/cber.18980310308.
- ↑ E. Knoevenagel: Zur Darstellung trockner Diazosalze. In: Berichte der Deutschen Chemischen Gesellschaft. 1890, Band 23, Nummer 2, S. 2994–2998 doi:10.1002/cber.189002302224.
- ↑ F. Knoop, Hubt. Oesterlin: Über die natürliche Synthese der Aminosäuren und ihre experimentelle Reproduktion. In: Hoppe-Seyler´s Zeitschrift für physiologische Chemie. 148, 1925, S. 294, doi:10.1515/bchm2.1925.148.3-6.294.
- ↑ Ludwig Knorr: Synthetische Versuche mit dem Acetessigester. In: Justus Liebig's Annalen der Chemie. 236, 1886, S. 69, doi:10.1002/jlac.18862360105.
- ↑ Ludwig Knorr: Einwirkung von Acetessigester auf Phenylhydrazin. In: Berichte der deutschen chemischen Gesellschaft. 16, 1883, S. 2597, doi:10.1002/cber.188301602194.
- ↑ Ludwig Knorr: Synthese von Pyrrolderivaten. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 1635, doi:10.1002/cber.18840170220.
- ↑ Shin-ichi Shirokawa, Masato Kamiyama, Tomoaki Nakamura, Masakazu Okada, Atsuo Nakazaki, Seijiro Hosokawa, Susumu Kobayashi: Remote Asymmetric Induction with Vinylketene SilylN,O-Acetal. In: Journal of the American Chemical Society. 2004, Band 126, Nummer 42, S. 13604–13605 doi:10.1021/ja0465855.
- ↑ Herbert Koch, Wolfgang Haaf: Über die Synthese verzweigter Carbonsäuren nach der Ameisensäure-Methode. In: Justus Liebigs Annalen der Chemie. 618, 1958, S. 251, doi:10.1002/jlac.19586180127.
- ↑ K. A. Kozeschkow: Untersuchungen über metallorganische Verbindungen, I. Mitteilung: Eine neue Klasse von Arylzinnverbindungen: Phenyl‐trihalogen‐stannane. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1929, Band 62, Nummer 4, S. 996–999 doi:10.1002/cber.19290620438.
- ↑ Stephen M. Neumann, Jay K. Kochi: Synthesis of olefins. Cross-coupling of alkenyl halides and Grignard reagents catalyzed by iron complexes. In: The Journal of Organic Chemistry. 1975, Band 40, Nummer 5, S. 599–606 doi:10.1021/jo00893a013.
- ↑ Jay K. Kochi: A New Method for Halodecarboxylation of Acids Using Lead(IV) Acetate. In: Journal of the American Chemical Society. 87, 1965, S. 2500, doi:10.1021/ja01089a041.
- ↑ Wilhelm Koenigs, Eduard Knorr: Ueber einige Derivate des Traubenzuckers und der Galactose. In: Berichte der deutschen chemischen Gesellschaft. 34, 1901, S. 957, doi:10.1002/cber.190103401162.
- ↑ E. P. Kohler, Geraldine Barrett: Isoxazoline oxide III. Triphenyl-isoxazoline oxide. In: Journal of the American Chemical Society. 1924, Band 46, Nummer 9, S. 2105–2113 doi:10.1021/ja01674a020.
- ↑ Hermann Kolbe: Zersetzung der Valeriansäure durch den elektrischen Strom. In: Annalen der Chemie und Pharmacie. 64, 1848, S. 339, doi:10.1002/jlac.18480640346.
- ↑ H. Kolbe: Ueber Synthese der Salicylsäure. In: Annalen der Chemie und Pharmacie. 113, 1860, S. 125, doi:10.1002/jlac.18601130120.
- ↑ R. Schmitt: Beitrag zur Kenntniss der Kolbe'schen Salicylsäure Synthese. In: Journal für Praktische Chemie. 31, 1885, S. 397, doi:10.1002/prac.18850310130.
- ↑ Patent DE930685: Verfahren zur vorzugsweisen Herstellung von Kohlenwasserstoffen durch katalytischen Umsatz von Kohlenoxyd und Wasserdampf. Veröffentlicht am 21. Juli 1955, Erfinder: Herbert Kölbel, Friedrich Engelhardt.
- ↑ J. Kondakoff: Ueber die Synthesen unter dem Einfluss von Zinkchlorid. In: Journal für praktische Chemie. 1893, Band 48, Nummer 1, S. 467–486 doi:10.1002/prac.18930480148.
- ↑ G. Ya. Kondrat'eva: In: Khim. Nauk. Prom.. 1957, 2, S. 666.
- ↑ Nathan Kornblum, Jack W. Powers, George J. Anderson, Willard J. Jones, Harold O. Larson, Oscar Levand, William M. Weaver: A NEW AND SELECTIVE METHOD OF OXIDATION. In: Journal of the American Chemical Society. 79, 1957, S. 6562, doi:10.1021/ja01581a057.
- ↑ Nathan Kornblum, Harold E. DeLaMare: THE BASE CATALYZED DECOMPOSITION OF A DIALKYL PEROXIDE. In: Journal of the American Chemical Society. 1951, Band 73, Nummer 2, S. 880–881 doi:10.1021/ja01146a542.
- ↑ Nicholas J. Bach, Edmund C. Kornfeld, N.D. Jones, Michael O. Chaney, Douglas E. Dorman, Jonathan W. Paschal, James A. Clemens, E. Barry Smalstig: Bicyclic and tricyclic ergoline partial structures. Rigid 3-(2-aminoethyl)pyrroles and 3- and 4-(2-aminoethyl)pyrazoles as dopamine agonists. In: Journal of Medicinal Chemistry. 1980, Band 23, Nummer 5, S. 481–491 doi:10.1021/jm00179a003.
- ↑ Azumi Hamasaki, Jeffrey M. Zimpleman, Inkyu Hwang, Dale L. Boger: Total Synthesis of Ningalin D. In: Journal of the American Chemical Society. 2005, Band 127, Nummer 30, S. 10767–10770 doi:10.1021/ja0526416.
- ↑ G. Körner, A. Contrardi: Vicinal 1,2,3-trinitrobenzene: a new trinitrotoluene and the corresponding dinitrohalogen substitution products. In: Atti Accad. nazl. Lincei . 1914, 23(II), S. 464-471.
- ↑ St. v. Kostanecki, A. Różycki: Ueber eine Bildungsweise von Chromonderivaten. In: Berichte der deutschen chemischen Gesellschaft. 34, 1901, S. 102, doi:10.1002/cber.19010340119.
- ↑ Roland Köster, Günter Bruno: Metallorganische Verbindungen, XXXIII Austausch von Kohlenwasserstoffresten zwischen organischen Aluminium‐ und Borverbindungen. In: Justus Liebig s Annalen der Chemie. 1960, Band 629, Nummer 1, S. 89–103 doi:10.1002/jlac.19606290109.
- ↑ Conrad J. Kowalski, M. S. Haque, Kevin Fields: Ester homologation via .alpha.-bromo .alpha.-keto dianion rearrangement. In: Journal of the American Chemical Society. 1985, Band 107, Nummer 5, S. 1429–1430 doi:10.1021/ja00291a063.
- ↑ F. Krafft: Ueber die Laurinsäure und ihre Umwandlung in Undecylsäure. In: Berichte der deutschen chemischen Gesellschaft. 12, 1879, S. 1664, doi:10.1002/cber.187901202126.
- ↑ A.Paul Krapcho, Gary A. Glynn, Brian J. Grenon: The decarbethoxylation of geminal dicarbethoxy compounds. In: Tetrahedron Letters. 8, 1967, S. 215, doi:10.1016/S0040-4039(00)90519-7.
- ↑ Norbert Schönberger, Günter Kresze: Zur Chemie der Schwefeldiimide, VI. Enreaktionen und [2 + 2]‐Cycloadditionen von N,N′‐Ditosylschwefeldiimid und N‐Sulfinyl‐p‐Toluolsulfonamid. In: Justus Liebig s Annalen der Chemie. 1975, Band 1975, Nummer 9, S. 1725–1731 doi:10.1002/jlac.197519750920.
- ↑ O. Kriewitz: Ueber Addition von Formaldehyd an einige Terpene. In: Berichte der Deutschen Chemischen Gesellschaft. 1899, Band 32, Nummer 1, S. 57–60 doi:10.1002/cber.18990320111.
- ↑ Cisco Bee, Soo Bong Han, Abbas Hassan, Hiroki Iida, Michael J. Krische: Diastereo- and Enantioselective Hydrogenative Aldol Coupling of Vinyl Ketones: Design of Effective Monodentate TADDOL-Like Phosphonite Ligands. In: Journal of the American Chemical Society. 2008, Band 130, Nummer 9, S. 2746–2747 doi:10.1021/ja710862u.
- ↑ Fritz Kröhnke, Erich Börner: Über α‐Keto‐aldonitrone und eine neue Darstellungsweise von α‐Keto‐aldehyden. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1936, Band 69, Nummer 8, S. 2006–2016 doi:10.1002/cber.19360690842.
- ↑ Wilfried Zecher, Fritz Kröhnke: Eine neue Synthese substituierter Pyridine, I. Grundzüge der Synthese. In: Chemische Berichte. 1961, Band 94, Nummer 3, S. 690–697 doi:10.1002/cber.19610940317.
- ↑ M. Kutscheroff: Beobachtungen über Bromvinyl. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 1532, doi:10.1002/cber.188101401319.
- ↑ Richard Kuhn, Hubert Roth: Mikro‐Bestimmung von Acetyl‐, Benzoyl‐ und C ‐Methylgruppen. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1933, Band 66, Nummer 9, S. 1274–1278 doi:10.1002/cber.19330660922.
- ↑ Richard Kuhn, Alfred Winterstein: Über konjugierte Doppelbindungen I. Synthese von Diphenyl-poly-enen. In: Helvetica Chimica Acta. 11, 1928, S. 87, doi:10.1002/hlca.19280110107.
- ↑ O. G. Kulinkovich, S. V. Sviridov, D. A. Vasilevskii, T. Pritytskaya. In: Zh. Org. Khim., 1989, 25, 2244.
- ↑ Kohei Tamao, Koji Sumitani, Makoto Kumada: Selective carbon-carbon bond formation by cross-coupling of Grignard reagents with organic halides. Catalysis by nickel-phosphine complexes. In: Journal of the American Chemical Society. 94, 1972, S. 4374, doi:10.1021/ja00767a075.
- ↑ Isao Kuwajima, Hirokazu Urabe: Regioselective arylation of silyl enol ethers of methyl ketones with aryl bromides. In: Journal of the American Chemical Society. 1982, Band 104, Nummer 24, S. 6831–6833 doi:10.1021/ja00388a083.
- ↑ Hitomi Suzuki, Takashi Murashima, Kazuhiro Shimizu, Kenkichi Tsukamoto: The Ozone-Mediated Reaction of Nonactivated Arenes with Nitrogen Oxides. In: Chemistry Letters. 1991, Band 20, Nummer 5, S. 817–818 doi:10.1246/cl.1991.817.
